ผศ.ดร. ป๋วย อุ่นใจ
ภาควิชาชีววิทยา คณะวิทยาศาสตร์ มหาวิทยาลัยมหิดล
นักวิจัยจากเนเธอแลนด์เปิดตัวงานวิจัยเลี้ยงสเต็มเซลล์แบบใหม่ กระตุ้นให้หลั่งน้ำตาได้ในหลอดทดลอง !
ที่จริง เราสามารแยกสเต็มเซลล์มาเพาะเลี้ยงในหลอดทดลองมาได้สักพักใหญ่ๆ แล้ว หรือแม้แต่กระตุ้นให้เซลล์อวัยวะต่างๆ เปลี่ยนย้อนวัยกลับไปเป็นสเต็มเซลล์ – ที่เรียกว่าเซลล์ iPS (induced pluripotent stem cell) ก็ยังทำได้
แต่การจะสั่งให้สเต็มเซลล์มาประกอบขึ้นเป็นเนื้อเยื่อ หรืออวัยวะใหม่ที่ทำงานได้จริงนั้น ยังคงเป็นสิ่งที่ท้าทาย
เทคโนโลยีสุดล้ำต่างๆ อาทิเช่น เครื่องพิมพ์อวัยวะสามมิติ (3D organ printing) เทคนิคการเตรียมโครงอวัยวะโดยการชะเซลล์ทิ้ง (Organ decellularization) และเทคนิคการเพาะเลี้ยงในถังปฏิกรณ์ชีวภาพ (Bioreactor) ที่ทำหน้าที่เหมือนเป็นครรภ์เทียม (Artificial womb) ถูกพัฒนาขึ้นมาเพื่อช่วยไกด์ให้สเต็มเซลล์ หรือแม้แต่เซลล์ที่เริ่มเปลี่ยนไปเป็นเซลล์ของอวัยวะต่างๆ นั้นสามารถประกอบตัวขึ้นมาเป็นอวัยวะใหม่ที่สามารถทำงานได้ได้
แม้หลายวิธีจะดูเหมือนประสบผลในระดับหนึ่ง อย่างเช่นการขึ้นรูปโครงพอลิเมอร์อาจจะช่วยให้วิศวกรเนื้อเยื่อสามารถเพาะเลี้ยงอวัยวะที่มีโครงสร้างเนื้อเยื่อไม่ซับซ้อนมาก อย่างกระเพาะปัสสาวะ (Urinary bladder) จนสามารถนำไปปลูกถ่ายกลับเข้าไปให้ผู้ป่วยได้
แต่เทคนิคในการประกอบอวัยวะที่มีความซับซ้อนยิ่งกว่านั้น นั้นยังพัฒนาไปได้ไม่ถึงไหน
การปลูกถ่ายเซลล์กลับเข้าไปในโครงหัวใจที่ผ่านการชะล้างเซลล์จนสิ้นแล้วจะสามารถฟื้นชีพหัวใจให้กลับมาเต้นได้ใหม่อีกครั้ง แต่ก็ยังถือว่าผิดปกติ เพราะแม้จะเต้นตุ๊บๆ เหมือนหัวใจจริง แต่จังหวะก็ยังไม่ได้ตามที่ควรจะเป็น
จุดพลิกของการเพาะเลี้ยงสเต็มเซลล์ในหลอดทดลองนั้นเกิดขึ้นในปี พ.ศ.2552 เมื่อทีมวิจัยของศาสตราจารย์ฮานส์ เคลเวอร์ (Hans Clevers) จากสถาบันฮูเบรกซ์ (Hubrecht Institute) มหาวิทยาลัยยูเทรกซ์ (Utrecht University) ประเทศเนเธอเเลนด์ สามารถพัฒนาวิธีการเพาะเลี้ยงสเต็มเซลล์จากลำไส้ได้สำเร็จในหลอดทดลอง
ซึ่งจริงๆ แค่นั้น ก็น่าตื่นเต้นมากแล้ว แต่ที่น่ากรี๊ดที่สุดก็คือเซลล์พวกนั้นมันมาประกอบตัวกันสร้างเป็นเนื้อเยื่อลำไส้ขนาดมินิ มีการสร้างคริปต์ (crypt) และวิลไล (villi) เหมือนกับที่เจอในผนังลำไส้ และด้วยความคล้ายคลึงกันมากในเชิงโครงสร้างระดับจุลภาคของเนื้อเยื่อลำไส้จิ๋วเมื่อเทียบกับลำไส้จริง แม้จะยังทำหน้าที่ได้ไม่สมบูรณ์นัก แต่ก็เป็นประโยชน์แล้วในการนำมาเป็นโมเดลในการศึกษาการทำงานของลำไส้ โดยเฉพาะอย่างยิ่งเอามาใช้ทดสอบความเป็นพิษของสารพิษต่างๆ กลไกการติดเชื้อของไวรัส รวมไปถึงการทดลองยาชนิดใหม่ๆ อีกด้วย
หลังจากที่ประสบความสำเร็จจากลำไส้จิ๋ว ทีมวิจัยของฮานส์ ก็ได้พัฒนาเทคโนโลยีการเลี้ยงอวัยวะมินิแบบนี้ขึ้นมาอีกกับอวัยวะอื่นๆ อีกมากมาย พวกเขาตั้งชื่ออวัยวะจิ๋วพวกนี้ว่าออร์แกนอยด์ (organoid)
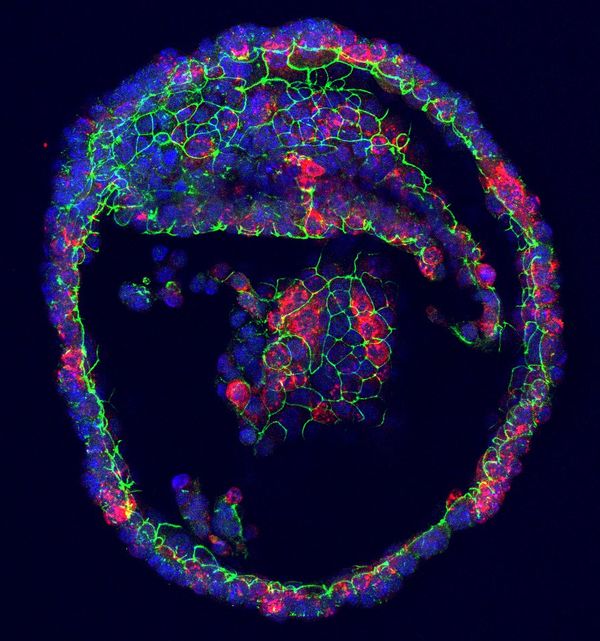
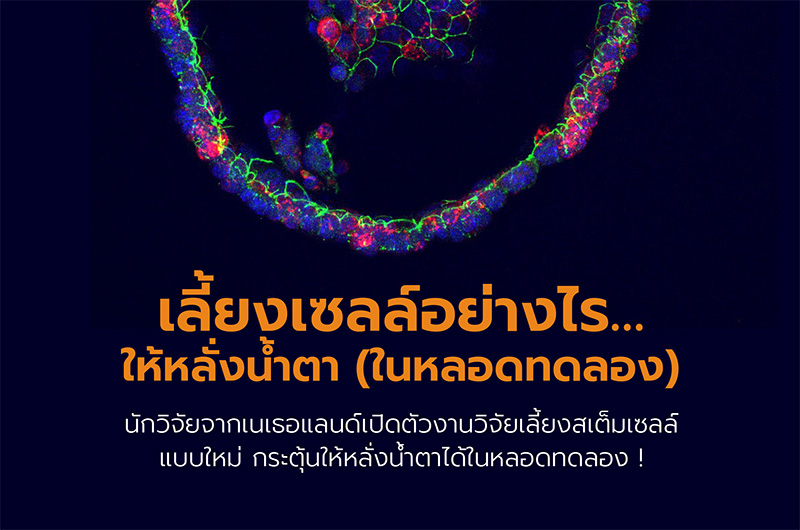
ภาพออร์แกนอยด์ต่อมน้ำตา สีแดงคือน้ำตาที่เซลล์สร้างขึ้น
(เครดิตภาพ Marie Bannier-Hélaouët / Hans Clevers, Hubrecht Institute, Utrech University)
และเมื่อกลางเดือนมีนาคม พ.ศ.2564 ที่ผ่านมา ทีมวิจัยของฮานส์ก็ได้ประกาศความสำเร็จอีกขั้น เขาสามารถกระตุ้นให้สเต็มเซลล์ในหลอดทดลองพัฒนาเป็นต่อมน้ำตาขนาดจิ๋วได้สำเร็จ
และที่สำคัญ ต่อมน้ำตาจิ๋วเหล่านี้ สามารถหลั่งน้ำตาออกมาได้จริงๆ !
ซึ่งถือเป็นเรื่องอัศจรรย์มาก และเป็นความสำเร็จครั้งยิ่งใหญ่ที่อาจจะสร้างองค์ความรู้ที่ทำให้เราเข้าใจกลไกการสร้างน้ำตา และช่วยหายุทธวิธีในการบรรเทาความทรมานให้กับผู้ป่วยที่มีปัญหาตาแห้ง (dry eyes) ที่มีอยู่มากมาย (ราวๆ 5 เปอร์เซ็นต์ของประชากรผู้ใหญ่ทั้งหมด) อีกทั้งยังอาจจะช่วยบรรเทาอาการเจ็บตาที่พบในผู้ป่วยแพ้ภูมิตนเองที่เกิดจากกลุ่มอาการโชเกร็น (Sjögren’s syndrome) ก็เป็นได้
ในปัจจุบัน วิธีการรักษาอาการเหล่านี้นั้นค่อนข้างจำกัด ส่วนใหญ่ก็จะให้หยอดน้ำตาเทียมเอา แต่ออแกนอยด์ที่เป็นแบบจำลองต่อมน้ำตานั้นถูกสร้างขึ้นมาและสามารถเพาะเลี้ยงได้ในหลอดทดลอง
เราจะสามารถเข้าใจกลไกการสร้างน้ำตา ยิ่งไปกว่านั้นเราอาจจะมองเห็นจุดที่ผิดปกติที่ทำให้ผู้ป่วยต้องทรมานจากอาการป่วยตาแห้ง นอกจากนี้ แบบจำลองต่อมน้ำตายังมีประโยชน์ในการทดสอบยา และวิธีใหม่ๆ แบบต่างๆ ที่อาจจะนำมาช่วยในการรักษาบรรเทาอาการตาแห้งจากสาเหตุต่างๆ ได้ด้วย
เพราะน้ำตาไม่ได้มีไว้แค่แสดงอารมณ์ แต่ยังเป็นสารให้ความชุ่มชื้นกับตา อีกทั้งยังมีฤทธิ์ในการช่วยป้องกันการติดเชื้อหลายชนิดได้อีกด้วย
ความยากมันอยู่ที่จะหาเซลล์ตั้งต้นจากต่อมน้ำตา (lacrimal gland) จะได้นำมาเลี้ยงให้เป็นต่อมน้ำตาในหลอดทดลอง
แต่ต่อมน้ำตามักมีขนาดเล็กมาก ว่าจะหาเจอก็แทบจะไม่เหลืออะไรแล้ว แต่ท้ายที่สุดทีมวิจัยของฮานส์ก็ทำได้สำเร็จ
หลังจากที่แยกต่อมน้ำตาออกมาได้แล้ว พวกเขาก็นำต่อมน้ำตาเหล่านี้ไปบดจนเป็นชิ้นจิ๋วๆ ก่อนจะนำไปเพาะเลี้ยงในเจลที่มีส่วนประกอบเป็นพวกสารเคลือบเซลล์สังเคราะห์ (artificial extracellular matrix) แล้วใส่ฮอร์โมนและโปรตีนต่างๆ ที่เกี่ยวข้องกับการพัฒนาของต่อมน้ำตาลงไป
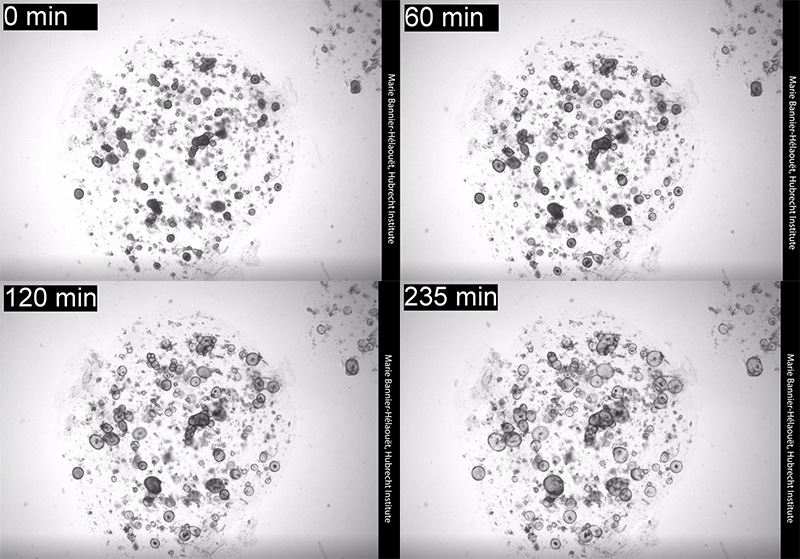 ภาพไทม์แลปส์แสดงการขยายตัวของออร์แกนอยด์หลังจากที่ถูกกระตุ้นด้วยอะดรีนาลีน ก้อนกลมๆ ที่ขยายคือออร์แกนอยด์
ภาพไทม์แลปส์แสดงการขยายตัวของออร์แกนอยด์หลังจากที่ถูกกระตุ้นด้วยอะดรีนาลีน ก้อนกลมๆ ที่ขยายคือออร์แกนอยด์
(เครดิตภาพ Marie Bannier-Hélaouët / Hans Clevers, Hubrecht Institute, Utrech University)
ปรากฏว่าต่อมน้ำตาชิ้นจิ๋วเติบโตกลายเป็นออแกนอยด์ก้อนกลมๆ เล็กๆ ในขวดเพาะเลี้ยง
“เราต้องปรับสูตรสารเคมีต่างๆ ที่จะใส่เข้าไปเพื่อควบคุมการเจริญของออร์แกนอยด์เพื่อกระตุ้นให้สเต็มเซลล์เปลี่ยนไปเป็นเซลล์ต่อมน้ำตาอย่างเต็มตัวแบบเดียวกับที่พบในต่อมน้ำตาของเราจริงๆ เพื่อที่พวกมันจะได้ร้องไห้ได้จริงๆ” แมรี่ แบนนิเออร์ (Marie Bannier-Hélaouët) ให้สัมภาษณ์ “ที่ท้าทายจริงๆ คือจะทำยังไงให้ออร์แกนอยด์ต่อมน้ำตาจิ๋วนี้ร้องไห้ออกมาได้จริง เพราะนี้คือจุดเด่นที่ชัดที่สุดของต่อมน้ำตา”
จะไปจิ้มให้มันเจ็บ ก็คงจะไม่ได้ แล้วจะทำอย่างไรดี
แต่สิ่งหนึ่งที่เรารู้คือเมื่อเวลาเราประสบอะไรที่ทำให้เราเจ็บปวด ร่างกายของเราจะหลั่งอะดรินาลีน (adrenaline) ออกมา
แมรี่ตัดสินใจทดลองเติมอะดรินาลีนลงไปให้ออร์แกนอยด์ต่อมน้ำตาจิ๋ว ปรากฏว่าสิ่งมหัศจรรย์ก็ได้เกิดขึ้น
ต่อมน้ำตาจิ๋วโป่งออกราวกับลูกโป่ง ข้างในต่อมน้ำตาคือน้ำตาที่เซลล์ข้างในต่อมนั้นผลิตออกมา แต่เนื่องจากต่อมที่โตในหลอดทดลองแบบนี้ไม่มีท่อน้ำตาที่จะนำน้ำตาออกมา น้ำตาก็เลยเอ่อล้นอยู่ข้างใน
จุดเด่นของการเพาะเลี้ยงออร์แกนอยด์ต่อมน้ำตาก็คือนักวิจัยสามารถใช้โมเดลนี้มาเป็นแบบจำลองในการศึกษาการทำงานของต่อมน้ำตาแบบเชิงลึก สามารถเจาะลงไปถึงกลไกการสร้างน้ำตาในระดับเซลล์ได้เลยทีเดียว อีกทั้งยังสามารถสกัดเอาน้ำตาออกมาวิเคราะห์องค์ประกอบได้อย่างง่ายดายเพราะในโมเดลนี้ น้ำตานั้นถูกเก็บไว้เป็นอย่างดีช้างในของออร์แกนอยด์
หรือถ้าอยากศึกษาเพิ่มเติมต่อไปว่าเมื่อไรต่อมจะหยุดผลิตน้ำตา หรือแม้แต่ว่าความผิดปกติอะไรที่จะทำให้ต่อมน้ำตาหยุดทำงาน จนทำให้เกิดการระคายเคือง หรืออาจจะลุกลามกลายเป็นโรคร้าย
หรือหากจะนำไปศึกษาว่าโรค สารเคมี หรือสารยาต่างๆ จะมีอิทธิพลอะไรบ้างกับการสร้างน้ำตาในต่อมน้ำตาก็ยังทำได้อีก
แต่ที่หลายคนสนใจมากกว่าก็คือจะทำอย่างไรถึงจะเอาต่อมน้ำตาจิ๋วเหล่านี้ ไปช่วยในการบรรเทาอาการของโรคทั้งตาแห้งและชูเกร็น เป็นไปได้หรือไม่ว่าต่อมน้ำตาเหล่านี้จะมีประโยชน์ในการรักษาโรค
ทีมของฮานส์ ได้ทำทดลองปลูกถ่ายต่อมน้ำตาจิ๋วของคนเหล่านี้เข้าไปในต่อมน้ำตาหนู ที่น่าแปลกใจคือหลังจากที่ปลูกถ่ายเข้าไปแล้ว ออร์แกนอยด์ต่อมน้ำตานั้นเปลี่ยนรูปร่างไปกลายเป็นหลอด ซึ่งเป็นเรื่องที่น่ายินดีเพราะหลอดน้ำตาเหล่านี้สามารถที่จะหลั่งน้ำตาออกมาได้ และอาจจะช่วยบรรเทาอาการตาแห้ง ขาดน้ำตาก็เป็นได้ ซึ่งก็คงต้องรอการทดสอบในขั้นคลินิกต่อไป
งานวิจัยนี้แม้จะดูเหมือนเป็นอีกหนึ่งงานวิจัยที่เน้นไปในการตีพิมพ์เผยแพร่ ซึ่งผลงานนี้ก็ออกมาเรียบร้อยแล้วในวารสาร Cell Stem Cell เมื่อเดือนมีนาคม 2021 ที่ผ่านมา แต่อยากแอบกระซิบเบาๆ ว่าองค์ความรู้จากงานวิจัยขึ้นหิ้งมากมายที่ฮานส์ได้สร้างขึ้นมาในด้านสเต็มเซลล์ทำให้เขาสามารถริเริ่มพัฒนาเทคโนโลยีออร์แกนอยด์ที่สามารถนำมาประยุกต์ใช้ในทางการแพทย์ได้อย่างแพร่หลาย
ในปี 2015 เขาและทีมได้ร่วมกันก่อตั้งบริษัทเซอร์โรเซน (Surrozen) สตาร์ตอัพสายดีปเทค (Deep tech) ที่เน้นการเอาองค์ความรู้ทางด้านเวชกรรมฟื้นฟู (regenerative medicine) มาใช้ในการรักษาและบรรเทาอาการป่วยต่างๆ ของคนไข้ได้เป็นที่เรียบร้อยแล้ว
เซอร์โรเซนตั้งอยู่ที่ซิลิคอน วัลเลย์ (Silicon Valley) แคลิฟอร์เนีย ประเทศสหรัฐอเมริกา

QR code ลิงก์ไปยัง Time lapse movies ที่แสดงการขยายตัวของออร์แกนอยด์
หลังจากที่ถูกกระตุ้นด้วยอะดรีนาลีน
(เครดิตภาพ Marie Bannier-Hélaouët / Hans Clevers, Hubrecht Institute, Utrech University)