การพัฒนาวัคซีนป้องกันโรคติดเชื้อไวรัสโคโรนาสายพันธุ์ใหม่ 2019 (COVID-19)
การพัฒนาวัคซีนป้องกันโรคติดเชื้อไวรัสโคโรนาสายพันธุ์ใหม่ 2019 (COVID-19)
วิจัยและพัฒนาโดย
วิจัยและพัฒนาโดย
วิจัยและพัฒนาโดย
ดร.อนันต์ จงแก้ววัฒนา
กลุ่มวิจัยนวัตกรรมสุขภาพสัตว์และการจัดการ (AVIG)
ศูนย์พันธุวิศวกรรมและเทคโนโลยีชีวภาพแห่งชาติ (BIOTEC)
โรคติดเชื้อไวรัสโคโรนาสายพันธุ์ใหม่ 2019 (COVID-19) เป็นโรคระบาดอุบัติใหม่ที่กำลังเป็นปัญหาสำคัญของประเทศไทยและของโลก ซึ่งเกิดจากเชื้อไวรัสสายพันธุ์ SARS-CoV-2 ที่สามารถติดเชื้อและแพร่กระจายในคนเป็นวงกว้าง ส่งผลกระทบต่อคุณภาพชีวิต สังคม และเศรษฐกิจอย่างมหาศาล กลุ่มวิจัยนวัตกรรมสุขภาพสัตว์และการจัดการ จึงอาศัยความเชี่ยวชาญจากการพัฒนาวัคซีนสำหรับไวรัสโคโรนาก่อโรคพีอีดีในสุกร และเทคโนโลยีรีเวอร์สเจเนติกส์ในการพัฒนาต้นแบบวัคซีนป้องกันโรค COVID-19 โดยมีรายละเอียดดังนี้
1) วัคซีนประเภท Virus-like particle (VLP) ได้สร้างพลาสมิดดีเอ็นเอที่มีการแสดงออกของโปรตีนสไปค์ของไวรัส SARS-CoV-2 แบบเต็มยีน และปรับตำแหน่งบริเวณปลายด้าน C-terminus เป็นส่วนของโปรตีน Hemagglutinin (HA) ของไวรัสไข้หวัดใหญ่ เพื่อความเข้ากันได้กับโปรตีน M1 ของไวรัสไข้หวัดใหญ่ที่ถูกสร้างขึ้นจากพลาสมิดอีกชิ้นหนึ่ง เมื่อนำส่งพลาสมิดทั้งสองเพื่อแสดงออกโปรตีนทั้งสองชนิดในเซลล์เดียวกัน (รูปภาพ) พบว่าอนุภาคไวรัสเสมือน (VLP) ที่มีการแสดงออกของโปรตีนสไปค์สามารถถูกปลดปล่อยออกมานอกเซลล์ได้และมีปริมาณใกล้เคียงกับไวรัสในธรรมชาติ
(ก)
(ข)
รูปภาพแสดงการสร้างอนุภาคไวรัสเสมือนที่มีการแสดงออกของโปรตีนสไปค์ของไวรัส SARS-CoV-2 โดย (ก) การสร้างพลาสมิดดีเอ็นเอที่มีการแสดงออกของโปรตีนสไปค์ของไวรัส SARS-CoV-2 แบบเต็มยีน และมีปลาย C-terminus เป็นส่วนของโปรตีน HA ของไวรัสไข้หวัดใหญ่ และ (ข) การสร้างอนุภาคไวรัสเสมือนจากการนำส่งพลาสมิดดีเอ็นเอที่มีการแสดงออกของโปรตีนสไปค์ของไวรัส SARS-CoV-2 แบบเต็มยีนและพลาสมิดที่มีการแสดงออกของโปรตีน M1 ของไวรัสไข้หวัดใหญ่เพื่อแสดงออกโปรตีนทั้งสองชนิดในเซลล์เดียวกัน
เมื่อทดสอบการกระตุ้นภูมิคุ้มกันในหนูทดลอง โดยการฉีดหนูทดลองจำนวน 2 เข็ม ห่างกันเข็มละ 3 สัปดาห์ พบว่าหนูสามารถสร้างแอนติบอดีต่อโปรตีนสไปค์ชัดเจน โดยเฉพาะหนูในกลุ่มที่ฉีด VLP พร้อมกับ Adjuvant ชนิด Alum สามารถกระตุ้นการสร้างแอนติบอดีได้สูงมาก โดยเมื่อนำซีรั่มของหนูไปทดสอบความสามารถยับยั้งการเข้าสู่เซลล์ของไวรัส SARS-CoV-2 (Virus neutralization test) ในห้องปฏิบัติการ BSL-3 พบว่าซีรั่มของหนูที่ได้รับ VLP พร้อม Adjuvant สามารถยับยั้งการติดเชื้อของไวรัสที่ระดับ 1:640 ถึงมากกว่า 1:2,000 (เทียบกับค่ามาตรฐาน 1:200 ที่เชื่อว่าเพียงพอต่อการป้องกันการติดเชื้อไวรัส) นอกจากนี้ประสบความสำเร็จในการสร้างเซลล์ที่มีการแสดงออกของทั้งโปรตีนสไปค์ และ M1 ในเซลล์เดียวกัน โดยเซลล์ดังกล่าวสามารถเลี้ยง VLP ในรูปแบบขยายขนาดได้ และแยก VLP จากน้ำเลี้ยงเซลล์มาทำให้บริสุทธิ์ได้เลย ทั้งนี้การทดสอบประสิทธิภาพการคุ้มโรคของ VLP ในหนูทดลองชนิด Human-ACE2 transgenic mice ที่ได้รับเชื้อ SARS-CoV-2 ในห้องปฏิบัติการ ABSL-3 คาดว่าจะดำเนินการภายในเดือนเมษายน 2564
2) วัคซีนประเภท Influenza-based ได้สร้างวัคซีนต้นแบบโดยอาศัยระบบการสร้างอนุภาคไวรัสไข้หวัดใหญ่สายพันธุ์ A/PR/8/34 (PR8) ที่เข้าสู่เซลล์ได้ครั้งเดียว (Single-cycle influenza virus, scIAV) โดยการแทนที่ยีน Receptor Binding Domain (RBD) ของโปรตีนสไปค์ของไวรัส SARS-CoV-2 ในยีน Hemagglutinin (HA) ในจีโนมของไวรัสไข้หวัดใหญ่ และเพิ่มปริมาณไวรัสดังกล่าวในเซลล์ที่ออกแบบให้มีการสร้างโปรตีน HA เพื่อทดแทนยีนของไวรัสที่สูญเสียไป (complementing cell line) (รูปภาพ)
(ก)
(ข)
รูปภาพแสดงการสร้างต้นแบบวัคซีนป้องกันโรคโควิด-19 แบบ influenza-based โดย (ก) การสร้างอนุภาคไวรัสไข้หวัดใหญ่สายพันธุ์ A/PR/8/34 (PR8) ที่แสดงออกโปรตีนสไปค์ของไวรัส SARS-CoV-2 และสามารถเข้าสู่เซลล์ได้ครั้งเดียว (Single-cycle influenza virus, scIAV) และ (ข) การเพิ่มปริมาณไวรัสดังกล่าวใน complementing cell line
ผลการทดสอบความสามารถในการกระตุ้นภูมิคุ้มกันในหนูทดลองสายพันธุ์ BALB/c แบบฉีดทางจมูกเป็นจำนวน 2 เข็ม ห่างกัน 14 วัน พบว่าหนูสามารถสร้างแอนติบอดีต่อโปรตีนสไปค์ได้ดี และมีการกระตุ้นภูมิคุ้มกันชนิด Cell-mediated immunity โดยวัดจาก T cell ในม้ามที่สามารถสร้าง IFN-gamma ได้หลังถูกกระตุ้นด้วยเปปไทด์ของโปรตีนสไปค์
อย่างไรก็ตามการสร้างไวรัสในรูปแบบดังกล่าวอาจเสียสภาพการสร้างแอนติเจนได้เร็ว เนื่องจากธรรมชาติไวรัสไข้หวัดใหญ่มีความไม่เสถียรของจีโนมสูง เกิด mutation ได้ง่ายและรวดเร็ว จึงได้ปรับการสร้างไวรัสให้มีความเสถียรขึ้น โดยผลการทดสอบหลังจากไวรัสถูกเลี้ยงต่อไปอย่างน้อย 5 ครั้ง พบว่าไวรัสยังสามารถสร้างแอนติเจนได้ในปริมาณสูง ซึ่งแสดงถึงเสถียรภาพของไวรัสของการนำไปใช้ต่อยอดเป็นวัคซีน ปัจจุบันอยู่ระหว่างการทดสอบประสิทธิภาพของวัคซีนชนิด Influenza-based เข็มแรกในรูปแบบปรับปรุงใหม่ในหนูแฮมสเตอร์ที่ได้รับเชื้อ SARS-CoV-2 โดยการทดสอบวัคซีนเข็มที่สองจะเริ่มดำเนินการในวันที่ 9 ม.ค. 2564 และการ challenge เชื้อในวันที่ 15 ม.ค. 2564
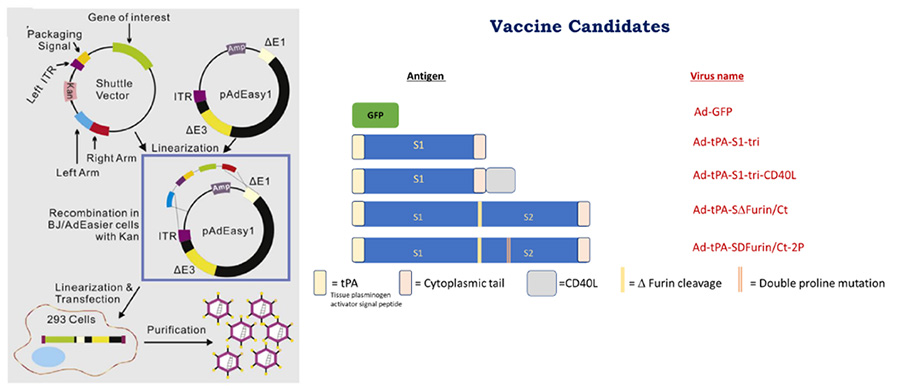
รูปภาพแสดงการสร้างต้นแบบวัคซีนป้องกันโรคโควิด-19 ด้วย Adenovirus serotype 5 (Ad5) ที่ผ่านการปรับพันธุกรรมให้อ่อนเชื้อ
ผลการทดสอบวัคซีนไวรัส
ผลการทดสอบวัคซีนไวรัสในหนูทดลองครั้งแรกด้วยวิธีฉีดเข้ากล้ามเนื้อเข็มเดียวโดยใช้ขนาด dose ที่ต่างกันคือ 108, 109 และ 1010 อนุภาค/มิลลิลิตร พบว่าหนูทุกตัวปลอดภัย ไม่มีอาการไม่พึงประสงค์หลังได้รับวัคซีน หลังจากนั้นทำการการุณยฆาตหนูทดลองที่ 3 สัปดาห์เพื่อตรวจสอบปริมาณแอนติบอดีในซีรั่มต่อโปรตีนสไปค์ด้วยวิธี ELISA พบว่าหนูในกลุ่มที่ได้รับวัคซีนไวรัสขนาด 109 และ 1010 อนุภาค/มิลลิลิตร สามารถตรวจวัดแอนติบอดีได้
แต่เมื่อนำซีรั่มดังกล่าวไปตรวจสอบหาแอนติบอดีชนิด neutralizing antibody ต่อไวรัส SARS-CoV-2 ในห้องปฏิบัติการ BSL-3 พบว่าปริมาณแอนติบอดียังอยู่ในระดับค่อนข้างต่ำ โดยสามารถยับยั้งการติดเชื้อไวรัสที่ระดับ 1:20 -1:80 แต่เมื่อนำตัวอย่างม้ามของหนูทดลองไปตรวจสอบปริมาณ T cell ที่ตอบสนองต่อเปปไทด์ของโปรตีนสไปค์ พบว่ามีการตอบสนองด้วยการสร้าง Interferon gamma ที่สูงมาก ซึ่งบ่งชี้ว่าการฉีดวัคซีน 1 เข็มสามารถกระตุ้นภูมิคุ้มกันชนิด cell-mediated immunity (CMI) ได้ภายใน 3 สัปดาห์
ผลการดำเนินงานในปี 2564 ได้เริ่มดำเนินการทดสอบวัคซีนในหนูทดลองครั้งที่ 2 เมื่อวันที่ 2 พ.ย 2563 โดยการฉีดวัคซีนไวรัสแบบเข็มเดียวเข้ากล้ามเนื้อและทางจมูกด้วยความเข้มข้น 1010 อนุภาค/มิลลิลิตร และทำการการุณยฆาตหนูทดลองหลังจากฉีดที่ 4 สัปดาห์ (วันที่ 30 พ.ย. 2563) โดยพบปริมาณ IgG ต่อโปรตีนสไปค์ของไวรัสสูงถึง 1:12,800 นอกจากนี้ได้ทำการทดสอบวัคซีนแบบให้ 2 เข็มในหนูอีกชุดหนึ่ง โดยเริ่มต้นจากการฉีดเข้ากล้ามเนื้อหรือทางจมูก (วันที่ 2 พ.ย. 2563) และอีกสามสัปดาห์ต่อมาหนูจะได้รับวัคซีนเข็มที่ 2 (วันที่ 23 พ.ย. 2563) หลังจากนั้นอีก 3 สัปดาห์ (วันที่ 16-17 ธ.ค. 2563)
โดยเมื่อทำการตรวจสอบภูมิคุ้มกันชนิด neutralizing antibody, T cell activation และการสร้างแอนติบอดีชนิด IgA ที่จำเพาะต่อไวรัส SARS-CoV-2 ในปอดของหนู พบว่าระดับภูมิคุ้มกันหลังการฉีดวัคซีนสามารถยับยั้งการติดเชื้อของไวรัสที่ระดับ 1:64 ถึง 1:1,024 โดยพบว่าทั้งการฉีดเข้ากล้ามเนื้อและพ่นเข้าจมูกสามารถกระตุ้น T cells ได้ และเมื่อตรวจสอบปริมาณแอนติบอดีชนิด IgA ที่จำเพาะต่อไวรัส SARS-CoV-2 ในปอดของหนูพบว่า การฉีดวัคซีนทางกล้ามเนื้อไม่สามารถกระตุ้น IgA ในปอดได้ จะต้องพ่นจมูกเท่านั้น ดังนั้นการพ่นวัคซีนเข้าสู่จมูกจึงมีประสิทธิภาพดีที่สุด
ปัจจุบันอยู่ระหว่างการหารือความร่วมมือกับ USAMD-AFRIMS ในการทดสอบประสิทธิภาพการคุ้มโรคของวัคซีนชนิด Ad5-S ในหนูทดลองชนิด Human-ACE2 transgenic mice โดยการ challenge ด้วยไวรัส SARS-CoV-2 ในห้องปฏิบัติการ ABSL-3
ติดต่อสอบถาม
ดร.อนันต์ จงแก้ววัฒนา
กลุ่มวิจัยนวัตกรรมสุขภาพสัตว์และการจัดการ (AVIG)
ศูนย์พันธุวิศวกรรมและเทคโนโลยีชีวภาพแห่งชาติ (BIOTEC)
-
สำนักงานพัฒนาวิทยาศาสตร์และเทคโนโลยีแห่งชาติ (สวทช.)
111 อุทยานวิทยาศาสตร์ประเทศไทย ถ.พหลโยธิน ต.คลองหนึ่ง อ.คลองหลวง จ.ปทุมธานี 12120
- โทรศัพท์: 0 2564 6700 ต่อ 3329-3331
- E-mail: icp-prs@biotec.or.th

