ยาต้นแบบ P218 สำหรับรักษาโรคมาลาเรีย
“มาลาเรีย” คือ 1 ใน 3 โรคติดเชื้อที่สำคัญของโลก ซึ่งทั่วโลกมีผู้ติดเชื้อมาลาเรียมากกว่า 200 ล้านคนต่อปี และเสียชีวิตมากกว่า 600,000 รายต่อปี มาลาเรียเกิดจากเชื้อโปรโตซัวชนิดพลาสโมเดียม (Plasmodium) ที่มียุงก้นปล่องเพศเมียเป็นพาหะ ปัจจุบันยังไม่มีวัคซีนเพื่อป้องกันการติดต่อของโรคได้อย่างมีประสิทธิภาพ และที่น่ากลัวกว่านั้นคือการพบการระบาดของเชื้อมาลาเรียสายพันธุ์ที่ดื้อยาเพิ่มขึ้น จึงนับเป็นความท้าทายให้นักวิทยาศาสตร์ทั่วโลกพัฒนายาต้านมาลาเรียชนิดใหม่เพื่อเตรียมรับมืออย่างเร่งด่วน
สำนักงานพัฒนาวิทยาศาสตร์และเทคโนโลยีแห่งชาติ (สวทช.) โดยศูนย์พันธุวิศวกรรมและเทคโนโลยีชีวภาพแห่งชาติ (ไบโอเทค) ได้ร่วมกับหน่วยงานภาคีต่างๆ ทั้งในและต่างประเทศทำวิจัยเกี่ยวกับโรคมาลาเรียมากว่า 30 ปี โดยมีเสาหลักสำคัญคือ ศาสตราจารย์เกียรติคุณ ดร.ยงยุทธ ยุทธวงศ์ ผู้เชี่ยวชาญอาวุโส สวทช. ซึ่งเป็นผู้บุกเบิกและทุ่มเทกับงานวิจัยพัฒนายาต้านมาลาเรียมาอย่างต่อเนื่อง กระทั่งประสบความสำเร็จค้นพบ ‘ยาต้านมาลาเรีย P218’
การพัฒนาสารต้านมาลาเรีย P218 ซึ่งเป็นสารต้านมาลาเรียตัวแรกที่ออกแบบและสังเคราะห์ขึ้นเองโดยนักวิจัยไทยจากไบโอเทค สวทช. นำโดย ศาสตราจารย์เกียรติคุณ ดร. ยงยุทธ ยุทธวงศ์ ผู้เชี่ยวชาญอาวุโส สวทช. (นักวิทยาศาสตร์คนแรกของโลกที่ค้นพบโครงสร้าง 3 มิติของโปรตีนของเชื้อมาลาเรีย ที่มีความสำคัญโดยเป็นเป้าหมายของยาต้านมาลาเรีย) และมีความร่วมมือกับนักวิจัยจากจุฬาลงกรณ์มหาวิทยาลัย มหาวิทยาลัยมหิดล London School of Hygiene and Tropical Medicine (LSHTM) ประเทศอังกฤษ และ Monash University ประเทศออสเตรเลีย โดยอาศัยองค์ความรู้จากการค้นพบโครงสร้างเอนไซม์เป้าหมายยาต้านมาลาเรีย ทำให้สามารถพัฒนาออกแบบสารต้านมาลาเรียมุ่งเป้าต่อเอนไซม์เป้าหมายได้อย่างจำเพาะเจาะจงและมีประสิทธิภาพทำลายเชื้อมาลาเรียที่ดื้อยาได้ การพัฒนาสารต้านมาลาเรียดังกล่าวได้รับการสนับสนุนงบประมาณวิจัยและพัฒนาทั้งจาก สวทช. และหน่วยงานต่างประเทศ คือ Medicines for Malaria Venture (MMV) ประเทศสวิตเซอร์แลนด์ ซึ่งเป็นองค์กรที่ไม่แสวงผลกำไรและเชี่ยวชาญเรื่องการพัฒนายารักษามาลาเรียระดับโลก เป้าหมายของทีมวิจัยคือการผลิตยาในรูปแบบยากิน ราคาถูก เพื่อเข้าถึงผู้ป่วยส่วนใหญ่ที่เป็นคนยากจน
สำนักงานพัฒนาวิทยาศาสตร์และเทคโนโลยีแห่งชาติ. (2564, มิถุนายน 9). “P218” สารต้านมาลาเรียชนิดใหม่ฝีมือคนไทย. https://www.nstda.or.th/home/performance_post/p218-antimalarial-agents/
ไทม์ไลน์การพัฒนายาต้นแบบ P218 สำหรับรักษาโรคมาลาเรีย
- พ.ศ. 2539 ไบโอเทค จัดตั้งห้องปฏิบัติการวิศวกรรมโปรตีน-ลิแกนด์และชีววิทยาโมเลกุล ภายใต้หน่วยปฏิบัติการวิจัยเทคโนโลยีชีวภาพ-โยธี
- พ.ศ. 2540–2546 ไบโอเทค พัฒนายาต้นแบบฯ มาอย่างต่อเนื่อง โดยร่วมมือกับ สำนักงานกองทุนสนับสนุนการวิจัย (สกว.) และ The Special Programme for Research and Training in Tropical Diseases (TDR/WHO)
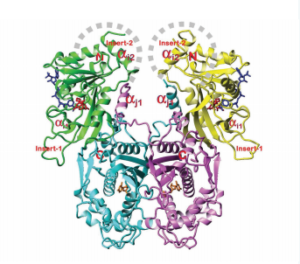
- พ.ศ. 2546 ค้นพบโครงสร้างเอมไซม์ Dihydrofolate Reductase (DHFR) ซึ่งเป็น breakthrough ของการพัฒนาและออกแบบยารักษาโรคมาลาเรียรุ่นใหม่ โดยการค้นพบนี้ถือเป็นความสำเร็จในการสังเคราะห์อนุพันธ์สารต้านมาลาเรียหลายชนิด เช่น กลุ่มไพริมีดีน มีการตีพิมพ์โครงสร้าง pf DHFR-TS เป็นครั้งแรกของโลก
- พ.ศ. 2551 ค้นพบยาต้นแบบ P218 ค้นพบสารแอนติโฟเลตต้นแบบต้านมาลาเรีย P218 ที่มีประสิทธิภาพและมีความจำเพาะสูงต่อเชื้อมาลาเรียดื้อยาและมีความปลอดภัยต่อสัตว์เลี้ยงลูกด้วยนม
- พ.ศ. 2551 (เดือนเมษายน) ศึกษา P218 พรีคลีนิกแบบ non-GLP (non-Good Laboratory Practices) หรือ การศึกษาที่ไม่จำเป็นต้องเป็นไปตามหลักเกณฑ์
- พ.ศ. 2552 (เดือนมีนาคม) P218 ผ่านการทดสอบระดับพรีคลีนิกแบบ non-GLP (non-Good Laboratory Practices)
- พ.ศ. 2557 (วันที่ 21 เมษายน) ศาสตราจารย์เกียรติคุณ ดร.ยงยุทธ ยุทธวงศ์ แถลงความสำเร็จของการวิจัยและพัฒนา สารเคมีสังเคราะห์ P218 เพื่อใช้ต้านเชื้อดื้อยาโรคมาลาเรีย โดยผ่านการทดสอบในระดับห้องปฏิบัติการ และความเป็นพิษของยาในสัตว์ทดลองประมาณ 1 ปีครึ่ง ขณะนี้เตรียมทดสอบในระดับคลินิกกับผู้ป่วยอีก 5 ปี เนื่องจากปัจจุบัน เชื้อมาลาเรียมีแนวโน้มที่จะดื้อต่อยา artemisinin ซึ่งเป็นยาที่ใช้รักษาอยู่ในประเทศไทย จึงต้องเร่งติดตามเฝ้าระวังเชื้อดื้อยาเหล่านี้ รวมถึงจำกัดการแพร่ระบาด การวิจัยได้ใช้สารสังเคราะห์ P218 ซึ่งเป็นโครงสร้างเอ็นไซม์ของเชื้อมาลาเรีย Dihydrofolate Reductase (DHFR) เมื่อตกผลึกนักวิจัยจึงได้ออกแบบโครงสร้างยาที่สามารถจับเอ็นไซม์ของเชื้อมาลาเรียชนิดนี้ได้ เพื่อยับยั้งการทำงานของเอ็นไซม์และทำลายเชื้อมาลาเรีย จุดเด่นของ P218 ไม่เพียงแต่สามารถรักษาเชื้อมาลาเรียดื้อยาได้เท่านั้น แต่ยังสามารถพัฒนาในรูปแบบยากิน ราคาประหยัดเพื่อให้ผู้ป่วยโดยเฉพาะในกลุ่มประชากรที่มีรายได้น้อยเข้าถึงได้ง่าย ทั้งนี้ สวทช. เตรียมดำเนินการความร่วมมือกับ Medicines for Malaria Venture หรือ MMV องค์กรในการพัฒนายารักษามาลาเรียระดับโลก เพื่อทดสอบระดับพรีคลินิกที่ได้มาตรฐาน GLP (Good Laboratory Practices) คาดว่าต้องใช้เวลาไม่ต่ำกว่า 5 ปี หากสำเร็จจะสามารถผลิตยาใช้ทดแทนยามาลาเรียในปัจจุบันที่เริ่มพบปัญหาการดื้อยาเพิ่มมากขึ้นเรื่อยๆ
- พ.ศ. 2558 (เดือนกันยายน) P218 ผ่านการทดสอบระดับพรีคลินิกแบบ GLP (Good Laboratory Practices) และผ่านกรรมการ “Global Safety Board” สามารถดำเนินการทดสอบครั้งแรกในมนุษย์ และขึ้นทะเบียนยาวิจัยใหม่ (investigational new drug)
- พ.ศ. 2562 ได้สาร P218 เป็นสารแอนติโฟเลตต้านมาลาเรียที่มีประสิทธิภาพที่ดีต่อเชื้อดั้งเดิมและเชื้อกลายพันธุ์ดื้อยา
- พ.ศ. 2562 (วันที่ 10 สิงหาคม) ไบโอเทค สวทช. ร่วมกับ สำนักงานพัฒนาเทคโนโลยีอวกาศและภูมิสารสนเทศ (องค์การมหาชน) ภายใต้โครงการ National Space Exploration ส่งงานวิจัย เรื่อง “การวิเคราะห์ปฏิสัมพันธ์ของโปรตีน-สารยับยั้ง และโปรตีน-โปรตีน สำหรับการพัฒนายาต้านมาลาเรีย” ของ ดร. ชัยรัตน์ อุทัยพิบูลย์ นักวิจัยอาวุโส ของไบโอเทค ขึ้นไปทดลองในห้องปฏิบัติการอวกาศคิโบโมดูล (Kibo Module) บนสถานีอวกาศนานาชาติ (International Space Station หรือ ISS) ขององค์การสำรวจอวกาศญี่ปุ่น (Japan Aerospace Exploration Agency: JAXA) ด้วยจรวด SpaceX CRS-18 เพื่อปลูกผลึกโปรตีน DHFR-TS ที่พบในเชื้อมาลาเรีย Plasmodium falciparum ซึ่งถือเป็นเป้าหมายสำคัญของยาต้านมาลาเรียในสภาวะไร้แรงโน้มถ่วงบนอวกาศ เพื่อให้ได้เห็นผลการทดลองที่แตกต่างออกไป คือ ลักษณะและคุณภาพของผลึกโปรตีนที่ดีกว่าการปลูกผลึกโปรตีนบนพื้นโลก เมื่อผลึกโปรตีนกลับสู่โลก ทีมวิจัยจะทำการวิเคราะห์โครงสร้างโปรตีนอย่างละเอียด ซึ่งจะช่วยให้สามารถออกแบบยาต้านมาลาเรียชนิดใหม่ที่มีความจำเพาะและประสิทธิภาพสูงขึ้น โดยเฉพาะต่อเชื้อที่ดื้อยา ถือเป็นอีกก้าวสำคัญของไทยในการประยุกต์ใช้เทคโนโลยีอวกาศเพื่อแก้ปัญหาสาธารณสุขระดับโลก
- พ.ศ. 2563 ไบโอเทค สวทช. ประสบความสำเร็จในการทดลองปลูกผลึกโปรตีนในสภาวะไร้น้ำหนักบนสถานีอวกาศนานาชาติ โดยได้ผลึกโปรตีนคุณภาพสูง ซึ่งมีความสำคัญต่อการออกแบบยาต้านเชื้อมาลาเรีย การตกผลึกโปรตีนช่วยให้นักวิจัยสามารถมองเห็นโครงสร้างสามมิติของโปรตีนเป้าหมายอย่างชัดเจน ทำให้สามารถออกแบบยาให้จับกับโปรตีนได้อย่างแม่นยำยิ่งขึ้น โดยในสภาวะไร้แรงโน้มถ่วง ผลึกโปรตีนจะเติบโตได้สมบูรณ์และเป็นธรรมชาติมากกว่าการตกผลึกบนโลก หลังการทดลอง ผลึกโปรตีนถูกส่งต่อไปยังองค์การสำรวจอวกาศญี่ปุ่น (Japan Aerospace Exploration Agency: JAXA) เพื่อวิเคราะห์โครงสร้างด้วยแสงซินโครตรอน ซึ่งข้อมูลการกระเจิงของแสงที่ได้จะถูกนำไปสร้างเป็นภาพจำลองสามมิติของโปรตีนในคอมพิวเตอร์ ช่วยระบุจุดที่เหมาะสมในการออกแบบสารออกฤทธิ์ต้านโปรตีนเป้าหมาย โปรตีนชนิดนี้มีบทบาทสำคัญต่อการดำรงชีวิตของเชื้อมาลาเรีย หากสามารถพัฒนายาที่หยุดยั้งการทำงานของโปรตีนนี้ได้ จะนำไปสู่แนวทางใหม่ในการรักษาและควบคุมโรคมาลาเรียในอนาคต
- พ.ศ. 2564 ค้นพบโปรตีนชื่อว่า “ซีรีนไฮครอกซีเมทิลทรานสเฟอเรส” (Serine hydroxymethyltransferase) หรือ SHMT เป็นเอนไซม์ในการสังเคราะห์โฟเลตเช่นเดียวกับเอนไซม์ DHFR จากการวิจัย การทำงานของเอมไซม์ SHMT เป็นสารที่มีความจำเพาะสูงได้นำมาต่อยอดใช้พัฒนาสารยับยั้ง เพื่อพัฒนายาต้านมาลาเรียที่มีประสิทธิภาพต่อไป
- พ.ศ. 2565 โครงการการค้นหาและประเมินศักยภาพของเอนไซม์ไลเกสชนิด E3 ของเชื้อมาลาเรียเพื่อใช้ในเทคโนโลยีฐาน PROTAC (Identification and Validation of Potential Plasmodium E3 Ligases for PROTAC Platform) โดย ดร.นิติพล ศรีมงคลพิทักษ์ ทีมวิจัยการออกแบบและวิศวกรรมชีวโมเลกุลขั้นแนวหน้า ไบโอเทค สวทช. ร่วมกับ FIMECS, Inc. ประเทศญี่ปุ่น ได้รับคัดเลือกสนับสนุนทุนวิจัย จำนวน 27,471,017 บาท (USD 838,587) จาก The Global Health Innovative Technology Fund โดย PROteolysis-TArgeting Chimeras (PROTACs) เป็นโมเลกุลยาขนาดเล็กรูปแบบใหม่ที่สามารถย่อยสลายโปรตีนเป้าหมายผ่านกลไก ubiquitin/proteasome ภายในเซลล์ เนื่องจาก PROTACs ย่อยสลายโปรตีนจึงมีศักยภาพในการรักษาอาการของโรค การใช้ PROTAC เป็นยาเป็นกระบวนทัศน์ใหม่ในการออกแบบยาที่สามารถมุ่งเป้าไปที่เป้าหมายยาได้หลากหลาย แม้กระทั้งเป้าหมายเก่าที่สามาถใช้เป็นเป้าหมายยาได้มาก่อน PROTACs ทำงานโดยการเชื่อมต่อ E3 ubiquitin ligase กับโปรตีน E3 ligase โดยสามารถเข้าย่อยสลายโปรตีนเป้าหมายโดยการทำให้โปรตีโซม (proteosome) แตกตัว ปัจจุบันมีการพัฒนาการใช้ PROTAC ในการพัฒนายาต้านมะเร็งในระดับคลินิก แต่ยังไม่มีการประยุกต์ใช้ PROTAC ในโรคติดเชื้อมาก่อน
- พ.ศ. 2566 เปิดตัวยารักษามาลาเรีย “P218” โดย สวทช. และมหาวิทยาลัยมหิดล ร่วมด้วยจุฬาลงกรณ์มหาวิทยาลัย มหาวิทยาลัยเกษตรศาสตร์ และหน่วยงานพันธมิตรทั้งในและต่างประเทศ ได้ร่วมกันพัฒนายามาลาเรีย ที่ได้ผลต่อเชื้อที่ดื้อยาที่เรียกว่า “แอนตีโฟเลต” โดยเป็นผลงานที่เริ่มจากการวิจัยขั้นพื้นฐานจนได้เป็นยาที่เรียกว่า “P218” ในขั้นต่อไปจะได้พัฒนาจนสามารถจดทะเบียนตำรับยา เพื่อผลิตใช้ในการป้องกันและรักษาได้ ซึ่งจะเป็นยาต้านมาลาเรียตัวแรกที่มาจากการค้นคิดและพัฒนาของคนไทยแบบครบวงจร โดยข้อตกลงความร่วมมือแรก สวทช. จะได้ทำร่วมกับ มหาวิทยาลัยมหิดล ซึ่งมีความสามารถและผลงานด้านการพัฒนายาสู่การจดทะเบียนและสู่ตลาดมานานแล้ว ปัจจุบัน มหาวิทยาลัยมหิดลได้ร่วมประชุมและลงมือทำวิจัยกับทีมนักวิจัยไบโอเทค สวทช. ในการพัฒนายา P218 มาเป็นระยะๆ และได้ทิศทางที่ชัดเจนในการผลักดันยา P218 ให้เข้าสู่ขั้นตอนที่จำเป็นตามเกณฑ์การขึ้นทะเบียนยาของไทยและระดับนานาชาติ รวมถึงได้เริ่มประสานงานกับสำนักงานคณะกรรมการอาหารและยา (อย.) กระทรวงสาธารณสุข ในเบื้องต้น เพื่อให้ อย. รับทราบเกี่ยวกับความพยายามดังกล่าว โดยคาดการณ์ว่าอาจสามารถดำเนินการเตรียมความพร้อมของข้อมูล รวมถึงวิจัยเพิ่มเติมอีกไม่เกิน 2 ปี จะสามารถเข้าสู่กระบวนการขอขึ้นทะเบียนยา P218 ได้เป็นผลสำเร็จ

หน่วยงานร่วมทำวิจัยเรื่องยาต้านมาลาเรีย
- หน่วยงานในประเทศไทย
- ศูนย์พันธุวิศวกรรมและเทคโนโลยีชีวภาพแห่งชาติ (ไบโอเทค) สำนักงานพัฒนาวิทยาศาสตร์และเทคโนโลยีแห่งชาติ (สวทช.)
- มหาวิทยาลัยมหิดล
- จุฬาลงกรณ์มหาวิทยาลัย
- สถาบันวิจัยแสงซินโครตรอน (องค์การมหาชน)
- สำนักงานพัฒนาเทคโนโลยีอวกาศและภูมิสารสนเทศ (องค์การมหาชน)
- หน่วยงานในต่างประเทศ
- Medicines for Malaria Venture (MMV) ประเทศสวิตเซอร์แลนด์
- London School of Hygiene & Tropical Medicine (LSHTM) สหราชอาณาจักร
- University of Edinburgh สหราชอาณาจักร
- Monash University ประเทศออสเตรเลีย
- National Synchrotron Radiation Research Center (NSRRC) ประเทศไต้หวัน
- Japan Aerospace Exploration Agency (JAXA) ประเทศญี่ปุ่น
- Japan Synchrotron Radiation Research Institute (JASRI) ประเทศญี่ปุ่น
บทสัมภาษณ์ ศาสตราจารย์เกียรติคุณ ดร.ยงยุทธ ยุทธวงศ์ ผู้เชี่ยวชาญอาวุโส สวทช. และ ดร.ชัยรัตน์ อุทัยพิบูลย์ อดีตนักวิจัยอาวุโส ไบโอเทค สวทช. 30th Anniversary Story of NSTDA: 30 ปี สวทช. วิจัยยาต้านมาลาเรียเพื่อมนุษยชาติ และวิดีโอสัมภาษณ์ 30 ปี สวทช. วิจัยยาต้านมาลาเรียเพื่อมนุษยชาติ
นักวิจัย สวทช. ได้ยื่นจดสิทธิบัตรเกี่ยวกับการพัฒนายาเพื่อรักษาโรคมาลาเรีย เพื่อคุ้มครองสิทธิในสิ่งประดิษฐ์หรือนวัตกรรม
นักวิจัย สวทช. ตีพิมพ์ผลงานเขียนเพื่อเผยแพร่องค์ความรู้เกี่ยวกับมาลาเรีย เช่น การพัฒนายารักษาโรคมาลาเรีย และการพัฒนาชุดตรวจหาเชื้อมาลาเรีย ด้านล่างแสดงรายการบทความวิจัยซึ่งตีพิมพ์เผยแพร่ในระบบนานาชาติ ตั้งแต่ปี 1996 จนถึงปัจจุบัน (เรียงลำดับรายการอ้างอิงตามปีที่ตีพิมพ์ โดยเริ่มจากปีที่เก่ากว่าไปยังปีที่ใหม่กว่า)
ปี 1996
- Prapunwattana, P., Sirawaraporn, W., Yuthavong, Y., & Santi, D. V. (1996). Chemical synthesis of the Plasmodium falciparum dihydrofolate reductase-thymidylate synthase gene. Molecular and Biochemical Parasitology, 83(1), 93–106. https://doi.org/10.1016/s0166-6851(96)02756-9
ปี 1997
- Kamchonwongpaisan, S., Samoff, E., & Meshnick, S. R. (1997). Identification of hemoglobin degradation products in Plasmodium falciparum. Molecular and Biochemical Parasitology, 86(2), 179–186. https://doi.org/10.1016/s0166-6851(97)02855-7
- Paitayatat, S., Tarnchompoo, B., Thebtaranonth, Y., & Yuthavong, Y. (1997). Correlation of antimalarial activity of artemisinin derivatives with binding affinity with ferroprotoporphyrin IX. Journal of Medicinal Chemistry, 40(5), 633–638. https://doi.org/10.1021/jm960767v
- Sirawaraporn, W., Sathitkul, T., Sirawaraporn, R., Yuthavong, Y., & Santi, D. V. (1997). Antifolate-resistant mutants of Plasmodium falciparum dihydrofolate reductase. Proceedings of the National Academy of Sciences of the United States of America, 94(4), 1124–1129. https://doi.org/10.1073/pnas.94.4.1124
ปี 1998
- Chanphen, R., Thebtaranonth, Y., Wanauppathamkul, S., & Yuthavong, Y. (1998). Antimalarial principles from Artemisia indica. Journal of Natural Products, 61(9), 1146–1147. https://doi.org/10.1021/np980041x
- McKie, J. H., Douglas, K. T., Chan, C., Roser, S. A., Yates, R., Read, M., Hyde, J. E., Dascombe, M. J., Yuthavong, Y., & Sirawaraporn, W. (1998). Rational drug design approach for overcoming drug resistance: application to pyrimethamine resistance in malaria. Journal of Medicinal Chemistry, 41(9), 1367–1370. https://doi.org/10.1021/jm970845u
ปี 1999
- Ekthawatchai, S., Isaka, M., Kittakoop, P., Kongsaeree, P., Sirichaiwat, C., Tanticharoen, M., Tarnchompoo, B., Thebtaranonth, Y., & Yuthavong, Y. (1999). Synthetic and naturally occurring antimalarials. Journal of Heterocyclic Chemistry, 36(6), 1599–1605. https://doi.org/10.1002/jhet.5570360621
- Isaka, M., Punya, J., Lertwerawat, Y., Tanticharoen, M., & Thebtaranonth, Y. (1999). Antimalarial activity of macrocyclic trichothecenes isolated from the fungus Myrothecium verrucaria. Journal of Natural Products, 62(2), 329–331. https://doi.org/10.1021/np980323x
- Olliaro, P. L., & Yuthavong, Y. (1999). An overview of chemotherapeutic targets for antimalarial drug discovery. Pharmacology & Therapeutics, 81(2), 91–110. https://doi.org/10.1016/s0163-7258(98)00036-9
ปี 2000
- Charoenteeraboon, J., Kamchonwongpaisan, S., Wilairat, P., Vattanaviboon, P., & Yuthavong, Y. (2000). Inactivation of artemisinin by thalassemic erythrocytes. Biochemical Pharmacology, 59(11), 1337–1344. https://doi.org/10.1016/s0006-2952(00)00271-9
- Isaka, M., Jaturapat, A., Kladwang, W., Punya, J., Lertwerawat, Y., Tanticharoen, M., & Thebtaranonth, Y. (2000). Antiplasmodial compounds from the wood-decayed fungus Xylaria sp. BCC 1067. Planta Medica, 66(5), 473–475. https://doi.org/10.1055/s-2000-8588
- Yuthavong, Y., Vilaivan, T., Chareonsethakul, N., Kamchonwongpaisan, S., Sirawaraporn, W., Quarrell, R., & Lowe, G. (2000). Development of a lead inhibitor for the A16V+S108T mutant of dihydrofolate reductase from the cycloguanil-resistant strain (T9/94) of Plasmodium falciparum. Journal of Medicinal Chemistry, 43(14), 2738–2744. https://doi.org/10.1021/jm0009181
ปี 2001
- Boonphong, S., Kittakoop, P., Isaka, M., Pittayakhajonwut, D., Tanticharoen, M., & Thebtaranonth, Y. (2001). Multiplolides A and B, new antifungal 10-membered lactones from Xylaria multiplex. Journal of Natural Products, 64(7), 965–967. https://doi.org/10.1021/np000291p
- Chinworrungsee, M., Kittakoop, P., Isaka, M., Rungrod, A., Tanticharoen, M., & Thebtaranonth, Y. (2001). Antimalarial halorosellinic acid from the marine fungus Halorosellinia oceanica. Bioorganic and Medicinal Chemistry Letters, 11(15), 1965-1969. https://doi.org/10.1016/S0960-894X(01)00327-4
- Ekthawatchai, S., Kamchonwongpaisan, S., Kongsaeree, P., Tarnchompoo, B., Thebtaranonth, Y., & Yuthavong, Y. (2001). C-16 artemisinin derivatives and their antimalarial and cytotoxic activities: Syntheses of artemisinin monomers, dimers, trimers, and tetramers by nucleophilic additions to artemisitene. Journal of Medicinal Chemistry, 44(26), 4688-4695. https://doi.org/10.1021/jm0103007
- Isaka, M., Tanticharoen, M., Kongsaeree, P., & Thebtaranonth, Y. (2001). Structures of cordypyridones A-D, antimalarial N-hydroxy- and N-methoxy-2-pyridones from the insect pathogenic fungus Cordyceps nipponica. Journal of Organic Chemistry, 66(14), 4803-4808. https://doi.org/10.1021/jo0100906
- Olliaro, P.L., Haynes, R.K., Meunier, B., & Yuthavong, Y. (2001). Possible modes of action of the artemisinin-type compounds. Trends in Parasitology, 17(3), 122-126. https://doi.org/10.1016/S1471-4922(00)01838-9
- Posner, G. H., & Meshnick, S. R. (2001). Radical mechanism of action of the artemisinin-type compounds. Trends in Parasitology, 17(6), 266–267. https://doi.org/10.1016/s1471-4922(01)02001-3
ปี 2002
- Chusacultanachai, S., Thiensathit, P., Tarnchompoo, B., Sirawaraporn, W., & Yuthavong, Y. (2002). Novel antifolate resistant mutations of Plasmodium falciparum dihydrofolate reductase selected in Escherichia coli. Molecular and Biochemical Parasitology, 120(1), 61–72. https://doi.org/10.1016/s0166-6851(01)00440-6
- Griffith, R., Chanphen, R., Leach, S. P., & Keller, P. A. (2002). New anti-Malarial compounds from database searching. Bioorganic & Medicinal Chemistry Letters, 12(4), 539–542. https://doi.org/10.1016/s0960-894x(01)00811-3
- Isaka, M., Suyarnsestakorn, C., Tanticharoen, M., Kongsaeree, P., & Thebtaranonth, Y. (2002). Aigialomycins A-E, new resorcylic macrolides from the marine mangrove fungus Aigialus parvus. The Journal of Organic Chemistry, 67(5), 1561–1566. https://doi.org/10.1021/jo010930g
- Leartsakulpanich, U., Imwong, M., Pukrittayakamee, S., White, N. J., Snounou, G., Sirawaraporn, W., & Yuthavong, Y. (2002). Molecular characterization of dihydrofolate reductase in relation to antifolate resistance in Plasmodium vivax. Molecular and Biochemical Parasitology, 119(1), 63–73. https://doi.org/10.1016/s0166-6851(01)00402-9
- Pittayakhajonwut, P., Theerasilp, M., Kongsaeree, P., Rungrod, A., Tanticharoen, M., & Thebtaranonth, Y. (2002). Pughiinin A, a sesquiterpene from the fungus Kionochaeta pughii BCC 3878. Planta Medica, 68(11), 1017–1019. https://doi.org/10.1055/s-2002-35653
- Tarnchompoo, B., Sirichaiwat, C., Phupong, W., Intaraudom, C., Sirawaraporn, W., Kamchonwongpaisan, S., Vanichtanankul, J., Thebtaranonth, Y., & Yuthavong, Y. (2002). Development of 2,4-diaminopyrimidines as antimalarials based on inhibition of the S108N and C59R+S108N mutants of dihydrofolate reductase from pyrimethamine-resistant Plasmodium falciparum. Journal of Medicinal Chemistry, 45(6), 1244–1252. https://doi.org/10.1021/jm010131q
- Vattanaviboon, P., Siritanaratkul, N., Ketpirune, J., Wilairat, P., & Yuthavong, Y. (2002). Membrane heme as a host factor in reducing effectiveness of dihydroartemisinin. Biochemical Pharmacology, 64(1), 91–98. https://doi.org/10.1016/s0006-2952(02)01060-2
- Yuthavong, Y. (2002). Basis for antifolate action and resistance in malaria. Microbes and Infection, 4(2), 175–182. https://doi.org/10.1016/s1286-4579(01)01525-8
ปี 2003
- Imwong, M., Pukrittayakamee, S., RéNia, L., Letourneur, F., Charlieu, J., Leartsakulpanich, U., Looareesuwan, S., White, N. J., & Snounou, G. (2003). Novel point mutations in the dihydrofolate reductase gene of Plasmodium vivax: Evidence for sequential selection by drug pressure. Antimicrobial Agents and Chemotherapy, 47(5), 1514–1521. https://doi.org/10.1128/aac.47.5.1514-1521.2003
- Sardarian, A., Douglas, K. T., Read, M., Sims, P. F. G., Hyde, J. E., Chitnumsub, P., Sirawaraporn, R., & Sirawaraporn, W. (2003). Pyrimethamine analogs as strong inhibitors of double and quadruple mutants of dihydrofolate reductase in human malaria parasites. Organic & Biomolecular Chemistry, 1(6), 960–964. https://doi.org/10.1039/b211636g
- Wattanarangsan, J., Chusacultanachai, S., Yuvaniyama, J., Kamchonwongpaisan, S., & Yuthavong, Y. (2003). Effect of N-terminal truncation of Plasmodium falciparum dihydrofolate reductase on dihydrofolate reductase and thymidylate synthase activity. Molecular and Biochemical Parasitology, 126(1), 97–102. https://doi.org/10.1016/s0166-6851(02)00240-2
- Yuvaniyama, J., Chitnumsub, P., Kamchonwongpaisan, S., Vanichtanankul, J., Sirawaraporn, W., Taylor, P., Walkinshaw, M. D., & Yuthavong, Y. (2003). Insights into antifolate resistance from malarial DHFR-TS structures. Nature Structural & Molecular Biology, 10(5), 357–365. https://doi.org/10.1038/nsb921
ปี 2004
- Corran, P. H., O’Donnell, R. A., Todd, J., Uthaipibull, C., Holder, A. A., Crabb, B. S., & Riley, E. M. (2004). The fine specificity, but not the invasion inhibitory activity, of 19-kilodalton merozoite surface protein 1-specific antibodies is associated with resistance to malarial parasitemia in a cross-sectional survey in The Gambia. Infection and Immunity, 72(10), 6185–6189. https://doi.org/10.1128/iai.72.10.6185-6189.2004
- Kongkasuriyachai, D., Fujioka, H., & Kumar, N. (2004). Functional analysis of Plasmodium falciparum parasitophorous vacuole membrane protein (Pfs16) during gametocytogenesis and gametogenesis by targeted gene disruption. Molecular and Biochemical Parasitology, 133(2), 275–285. https://doi.org/10.1016/j.molbiopara.2003.10.014
- Okech, B. A., Corran, P. H., Todd, J., Joynson-Hicks, A., Uthaipibull, C., Egwang, T. G., Holder, A. A., & Riley, E. M. (2004). Fine specificity of serum antibodies to Plasmodium falciparum merozoite surface protein, PfMSP-1(19), predicts protection from malaria infection and high-density parasitemia. Infection and Immunity, 72(3), 1557–1567. https://doi.org/10.1128/iai.72.3.1557-1567.2004
- Sawadjoon, S., Kittakoop, P., Isaka, M., Kirtikara, K., Madla, S., & Thebtaranonth, Y. (2004). Antiviral and antiplasmodial spirodihydrobenzofuran terpenes from the fungus Stachybotrys nephrospora. Planta Medica, 70(11), 1085–1087. https://doi.org/10.1055/s-2004-832652
- Scholl, P. F., Kongkasuriyachai, D., Demirev, P. A., Feldman, A. B., Lin, J. S., Sullivan, D. J., & Kumar, N. (2004). Rapid detection of malaria infection in vivo by laser desorption mass spectrometry. American Journal of Tropical Medicine and Hygiene, 71(5), 546–551. https://doi.org/10.4269/ajtmh.2004.71.546
ปี 2005
- Chanama, M., Chitnumsub, P., & Yuthavong, Y. (2005). Subunit complementation of thymidylate synthase in Plasmodium falciparum bifunctional dihydrofolate reductase-thymidylate synthase. Molecular and Biochemical Parasitology, 139(1), 83–90. https://doi.org/10.1016/j.molbiopara.2004.09.010
- Kongsaeree, P., Khongsuk, P., Leartsakulpanich, U., Chitnumsub, P., Tarnchompoo, B., Walkinshaw, M. D., & Yuthavong, Y. (2005). Crystal structure of dihydrofolate reductase from Plasmodium vivax : Pyrimethamine displacement linked with mutation-induced resistance. Proceedings of the National Academy of Sciences, 102(37), 13046–13051. https://doi.org/10.1073/pnas.0501747102
- Yuthavong, Y., Yuvaniyama, J., Chitnumsub, P., Vanichtanankul, J., Chusacultanachai, S., Tarnchompoo, B., Vilaivan, T., & Kamchonwongpaisan, S. (2005). Malarial (Plasmodium falciparum) dihydrofolate reductase-thymidylate synthase: structural basis for antifolate resistance and development of effective inhibitors. Parasitology, 130(3), 249–259. https://doi.org/10.1017/s003118200400664x
ปี 2006
- Bunyarataphan, S., Leartsakulpanich, U., Taweechai, S., Tarnchompoo, B., Kamchonwongpaisan, S., & Yuthavong, Y. (2006). Evaluation of the activities of pyrimethamine analogs against Plasmodium vivax and Plasmodium falciparum dihydrofolate reductase-thymidylate synthase using in vitro enzyme inhibition and bacterial complementation assays. Antimicrobial Agents and Chemotherapy, 50(11), 3631–3637. https://doi.org/10.1128/aac.00448-06
ปี 2007
- Gale, G. A., Kirtikara, K., Pittayakhajonwut, P., Sivichai, S., Thebtaranonth, Y., Thongpanchang, C., & Vichai, V. (2007). In search of cyclooxygenase inhibitors, anti-Mycobacterium tuberculosis and anti-malarial drugs from Thai flora and microbes. Pharmacology & Therapeutics, 115(3), 307–351. https://doi.org/10.1016/j.pharmthera.2007.03.016
- Isaka, M., Boonkhao, B., Rachtawee, P., & Auncharoen, P. (2007). A xanthocillin-like alkaloid from the insect pathogenic fungus Cordyceps brunnearubra BCC 1395. Journal of Natural Products, 70(4), 656–658. https://doi.org/10.1021/np060509t
- Kamchonwongpaisan, S., Vanichtanankul, J., Taweechai, S., Chitnumsub, P., & Yuthavong, Y. (2007). The role of tryptophan-48 in catalysis and binding of inhibitors of Plasmodium falciparum dihydrofolate reductase. International Journal for Parasitology, 37(7), 787–793. https://doi.org/10.1016/j.ijpara.2006.12.017
- Polpanich, D., Tangboriboonrat, P., & Elaissari, A. (2007). Evolution in malaria disease detection: from parasite visualization to colloidal‐based rapid diagnostic. Colloidal Nanoparticles in Biotechnology, 65–93. https://doi.org/10.1002/9780470258552.ch3
- Ponmee, N., Chuchue, T., Wilairat, P., Yuthavong, Y., & Kamchonwongpaisan, S. (2007). Artemisinin effectiveness in erythrocytes is reduced by heme and heme-containing proteins. Biochemical Pharmacology, 74(1), 153–160. https://doi.org/10.1016/j.bcp.2007.03.008
- Shaw, P. J., Ponmee, N., Karoonuthaisiri, N., Kamchonwongpaisan, S., & Yuthavong, Y. (2007). Characterization of human malaria parasite Plasmodium falciparum eIF4E homologue and mRNA 5′ cap status. Molecular and Biochemical Parasitology, 155(2), 146–155. https://doi.org/10.1016/j.molbiopara.2007.07.003
ปี 2008
- Ganesan, K., Ponmee, N., Jiang, L., Fowble, J. W., White, J., Kamchonwongpaisan, S., Yuthavong, Y., Wilairat, P., & Rathod, P. K. (2008). A genetically hard-wired metabolic transcriptome in Plasmodium falciparum fails to mount protective responses to lethal antifolates. PLoS Pathogens, 4(11), e1000214. https://doi.org/10.1371/journal.ppat.1000214
- Jenwitheesuk, E., Horst, J., Rivas, K., Vanvoorhis, W., & Samudrala, R. (2008). Novel paradigms for drug discovery: computational multitarget screening. Trends in Pharmacological Sciences, 29(2), 62–71. https://doi.org/10.1016/j.tips.2007.11.007
- Leartsakulpanich, U., Kongkasuriyachai, D., Imwong, M., Chotivanich, K., & Yuthavong, Y. (2007). Cloning and characterization of Plasmodium vivax serine hydroxymethyltransferase. Parasitology International, 57(2), 223–228. https://doi.org/10.1016/j.parint.2007.11.001
ปี 2009
- Bunyapaiboonsri, T., Yoiprommarat, S., Intereya, K., Rachtawee, P., Hywel-Jones, N. L., & Isaka, M. (2009). Isariotins E and F, spirocyclic and bicyclic hemiacetals from the entomopathogenic fungus Isaria tenuipes BCC 12625. Journal of Natural Products, 72(4), 756–759. https://doi.org/10.1021/np800702c
- Cruz, A., De Toledo, J., Falade, M., Terrao, M., Kamchonwongpaisan, S., Kyle, D., & Uthaipibull, C. (2009). Current treatment and drug discovery against Leishmania spp. and Plasmodium spp.: a review. Current Drug Targets, 10(3), 178–192. https://doi.org/10.2174/138945009787581177
- Dasgupta, T., Chitnumsub, P., Kamchonwongpaisan, S., Maneeruttanarungroj, C., Nichols, S. E., Lyons, T. M., Tirado-Rives, J., Jorgensen, W. L., Yuthavong, Y., & Anderson, K. S. (2009). Exploiting structural analysis, in silico screening, and serendipity to identify novel inhibitors of Drug-Resistant falciparum malaria. ACS Chemical Biology, 4(1), 29–40. https://doi.org/10.1021/cb8002804
- Lozovsky, E. R., Chookajorn, T., Brown, K. M., Imwong, M., Shaw, P. J., Kamchonwongpaisan, S., Neafsey, D. E., Weinreich, D. M., & Hartl, D. L. (2009). Stepwise acquisition of pyrimethamine resistance in the malaria parasite. Proceedings of the National Academy of Sciences, 106(29), 12025–12030. https://doi.org/10.1073/pnas.0905922106
- Okafor, C. M., Anumudu, C. I., Omosun, Y. O., Uthaipibull, C., Ayede, I., Awobode, H. O., Odaibo, A. B., Langhorne, J., Holder, A. A., Nwuba, R. I., & Troye-Blomberg, M. (2009). Cellular responses to modified Plasmodium falciparum MSP119 antigens in individuals previously exposed to natural malaria infection. Malaria Journal, 8(1). https://doi.org/10.1186/1475-2875-8-263
- Polpanich, D., Tangboriboonrat, P., & Elaissari, A. (2009). Preparation and agglutination of Immuno-Nanolatex for malaria diagnosis. Journal of Biomedical Nanotechnology, 5(5), 486–492. https://doi.org/10.1166/jbn.2009.1037
ปี 2010
- Haritakun, R., Rachtawee, P., Chanthaket, R., Boonyuen, N., & Isaka, M. (2010). Butyrolactones from the Fungus Aspergillus terreus BCC 4651. Chemical and Pharmaceutical Bulletin, 58(11), 1545–1548. https://doi.org/10.1248/cpb.58.1545
- Isaka, M., Yangchum, A., Rachtawee, P., Komwijit, S., & Lutthisungneon, A. (2010). Hopane-type triterpenes and binaphthopyrones from the scale insect pathogenic fungus Aschersonia paraphysata BCC 11964. Journal of Natural Products, 73(4), 688–692. https://doi.org/10.1021/np1000363
- Nzila, A., Rottmann, M., Chitnumsub, P., Kiara, S. M., Kamchonwongpaisan, S., Maneeruttanarungroj, C., Taweechai, S., Yeung, B. K. S., Goh, A., Lakshminarayana, S. B., Zou, B., Wong, J., Ling, N., MA, Weaver, M., Keller, T. H., Dartois, V., Wittlin, S., Brun, R., Yuthavong, Y., & Diagana, T. T. (2010). Preclinical evaluation of the antifolate QN254, 5-Chloro-N′6′-(2,5-Dimethoxy-Benzyl)-Quinazoline-2,4,6-Triamine, as an antimalarial drug candidate. Antimicrobial Agents and Chemotherapy, 54(6), 2603–2610. https://doi.org/10.1128/aac.01526-09
- Wangchuk, P., Bremner, J. B., Samten, N., Rattanajak, R., & Kamchonwongpaisan, S. (2010). Antiplasmodial agents from the Bhutanese medicinal plant Corydalis calliantha. Phytotherapy Research, 24(4), 481–485. https://doi.org/10.1002/ptr.2893
Wangchuk, P., Bremner, J. B., Samten, N., Skelton, B. W., White, A. H., Rattanajak, R., & - Kamchonwongpaisan, S. (2010). Antiplasmodial activity of atisinium chloride from the Bhutanese medicinal plant, Aconitum orochryseum. Journal of Ethnopharmacology, 130(3), 559–562. https://doi.org/10.1016/j.jep.2010.05.057
ปี 2011
- Chanama, M., Chanama, S., Shaw, P. J., Chitnumsub, P., Leartsakulpanich, U., & Yuthavong, Y. (2011). Formation of catalytically active cross-species heterodimers of thymidylate synthase from Plasmodium falciparum and Plasmodium vivax. Molecular Biology Reports, 38(2), 1029–1037. https://doi.org/10.1007/s11033-010-0199-7
- Kaewkamnerd, S., Intarapanich, A., Pannarat, M., Chaotheing, S., Uthaipibull, C., & Tongsima, S. (2011). Detection and classification device for malaria parasites in thick-blood films. Proceedings of the 6th IEEE International Conference on Intelligent Data Acquisition and Advanced Computing Systems: Technology and Applications, IDAACS’2011, 435–438. https://doi.org/10.1109/idaacs.2011.6072791
- Kritsiriwuthinan, K., Chaotheing, S., Shaw, P. J., Wongsombat, C., Chavalitshewinkoon-Petmitr, P., & Kamchonwongpaisan, S. (2011). Global gene expression profiling of Plasmodium falciparum in response to the anti-malarial drug pyronaridine. Malaria Journal, 10(1). https://doi.org/10.1186/1475-2875-10-242
- Roobsoong, W., Roytrakul, S., Sattabongkot, J., Li, J., Udomsangpetch, R., & Cui, L. (2011). Determination of the Plasmodium vivax schizont stage proteome. Journal of Proteomics, 74(9), 1701–1710. https://doi.org/10.1016/j.jprot.2011.03.035
- Somsak, V., Srichairatanakool, S., Kamchonwongpaisan, S., Yuthavong, Y., & Uthaipibull, C. (2011). Small-scale in vitro culture and purification of Plasmodium berghei for transfection experiment. Molecular and Biochemical Parasitology, 177(2), 156–159. https://doi.org/10.1016/j.molbiopara.2011.01.013
- Somsak, V., Uthaipibull, C., Prommana, P., Srichairatanakool, S., Yuthavong, Y., & Kamchonwongpaisan, S. (2011). Transgenic Plasmodium parasites stably expressing Plasmodium vivax dihydrofolate reductase-thymidylate synthase as in vitro and in vivo models for antifolate screening. Malaria Journal, 10(1). https://doi.org/10.1186/1475-2875-10-291
- Tipsuwan, W., Srichairatanakool, S., Kamchonwongpaisan, S., Yuthavong, Y., & Uthaipibull, C. (2011). Selection of drug resistant mutants from random library of Plasmodium falciparum dihydrofolate reductase in Plasmodium berghei model. Malaria Journal, 10(1). https://doi.org/10.1186/1475-2875-10-119
- Tipsuwan, W., Srichairatanakool, S., Kamchonwongpaisan, S., Yuthavong, Y., & Uthaipibull, C. (2011). Identification of Pfdhfr mutant variants in plasmodium berghei model. Maejo International Journal of Science and Technology, 5(3), 401-412
- Wangchuk, P., Keller, P. A., Pyne, S. G., Taweechotipatr, M., Tonsomboon, A., Rattanajak, R., & Kamchonwongpaisan, S. (2011). Evaluation of an ethnopharmacologically selected Bhutanese medicinal plants for their major classes of Phytochemicals and biological activities. Journal of Ethnopharmacology, 137(1), 730–742. https://doi.org/10.1016/j.jep.2011.06.032
ปี 2012
- Kornsakulkarn, J., Saepua, S., Srichomthong, K., Supothina, S., & Thongpanchang, C. (2012). New mycotoxins from the scale insect fungus Aschersonia coffeae Henn. BCC 28712. Tetrahedron, 68(40), 8480–8486. https://doi.org/10.1016/j.tet.2012.07.059
- Maturos, T., Pogfay, T., Rodaree, K., Chaotheing, S., Jomphoak, A., Wisitsoraat, A., Suwanakitti, N., Wongsombat, C., Jaruwongrungsee, K., Shaw, P., Kamchonwongpaisan, S., & Tuantranont, A. (2012). Enhancement of DNA hybridization under acoustic streaming with three-piezoelectric-transducer system. Lab on a Chip, 12(1), 133–138. https://doi.org/10.1039/c1lc20720b
- Pornthanakasem, W., Kongkasuriyachai, D., Uthaipibull, C., Yuthavong, Y., & Leartsakulpanich, U. (2012). Plasmodium serine hydroxymethyltransferase: indispensability and display of distinct localization. Malaria Journal, 11(1). https://doi.org/10.1186/1475-2875-11-387
- Somsak, V., Srichairatanakool, S., Yuthavong, Y., Kamchonwongpaisan, S., & Uthaipibull, C. (2012). Flow cytometric enumeration of Plasmodium berghei-infected red blood cells stained with SYBR Green I. Acta Tropica, 122(1), 113–118. https://doi.org/10.1016/j.actatropica.2011.12.010
- Supong, K., Thawai, C., Suwanborirux, K., Choowong, W, Supothina, S, & Pittayakhajonwut, P. (2012). Antimalarial and antitubercular C-glycosylated benz[α]anthraquinones from the marine-derived Streptomyces sp. BCC45596. Phytochemistry Letters, 5(3), 651–655. https://doi.org/10.1016/j.phytol.2012.06.015
- Vanichtanankul, J., Taweechai, S., Uttamapinant, C., Chitnumsub, P., Vilaivan, T., Yuthavong, Y., & Kamchonwongpaisan, S. (2012). Combined spatial limitation around residues 16 and 108 of Plasmodium falciparum dihydrofolate reductase explains resistance to cycloguanil. Antimicrobial Agents and Chemotherapy, 56(7), 3928–3935. https://doi.org/10.1128/aac.00301-12
- Yuthavong, Y., Tarnchompoo, B., Vilaivan, T., Chitnumsub, P., Kamchonwongpaisan, S., Charman, S. A., McLennan, D. N., White, K. L., Vivas, L., Bongard, E., Thongphanchang, C., Taweechai, S., Vanichtanankul, J., Rattanajak, R., Arwon, U., Fantauzzi, P., Yuvaniyama, J., Charman, W. N., & Matthews, D. (2012). Malarial dihydrofolate reductase as a paradigm for drug development against a resistance-compromised target. Proceedings of the National Academy of Sciences, 109(42), 16823–16828. https://doi.org/10.1073/pnas.1204556109
ปี 2013
- Boonlarppradab, C., Suriyachadkun, C., Rachtawee, P., & Choowong, W. (2013). Saccharosporones A–C, cytotoxic angucyclinone antibiotics from Saccharopolyspora sp. BCC 21906. Journal of Antibiotics, 66(6), 305–309. https://doi.org/10.1038/ja.2013.16
- Nugraha, A. S., Haritakun, R., & Keller, P. A. (2013). Constituents of the Indonesian Epiphytic Medicinal Plant Drynaria rigidula. Natural Product Communications, 8(6). https://doi.org/10.1177/1934578×1300800606
- Prommana, P., Uthaipibull, C., Wongsombat, C., Kamchonwongpaisan, S., Yuthavong, Y., Knuepfer, E., Holder, A. A., & Shaw, P. J. (2013). Inducible knockdown of plasmodium gene expression using the GLMS ribozyme. PLoS ONE, 8(8), e73783. https://doi.org/10.1371/journal.pone.0073783
- Somsak, V., Jaihan, U., Srichairatanakool, S., & Uthaipibull, C. (2013). Protection of renal function by green tea extract during Plasmodium berghei infection. Parasitology International, 62(6), 548–551. https://doi.org/10.1016/j.parint.2013.08.004
- Sor-Suwan, S., Jariyapan, N., Roytrakul, S., Paemanee, A., Saeung, A., Thongsahuan, S., Phattanawiboon, B., Bates, P. A., Poovorawan, Y., & Choochote, W. (2013). Salivary gland proteome of the human malaria vector, Anopheles campestris-like (Diptera: Culicidae). Parasitology Research, 112(3), 1065–1075. https://doi.org/10.1007/s00436-012-3233-y
- Tangchaikeeree, T., Jangpatarapongsa, K., Polpanich, D., Thiramanas, R., Pornjarone, A., Udnaen, S., Udomsangpetch, R., & Tangboriboonrat, P. (2013). Enrichment of malaria parasites by antibody immobilized magnetic nanoparticles. Journal of Biomedical Nanotechnology, 9(10), 1768–1775. https://doi.org/10.1166/jbn.2013.1669
- Thiramanas, R., Jangpatarapongsa, K., Asawapirom, U., Tangboriboonrat, P., & Polpanich, D. (2013). Sensitivity and specificity of PS/AA‐modified nanoparticles used in malaria detection. Microbial Biotechnology, 6(4), 406–413. https://doi.org/10.1111/1751-7915.12021
- Van Huijsduijnen, R. H., Guy, R. K., Chibale, K., Haynes, R. K., Peitz, I., Kelter, G., Phillips, M. A., Vennerstrom, J. L., Yuthavong, Y., & Wells, T. N. C. (2013). Anticancer properties of distinct antimalarial drug classes. PLoS ONE, 8(12), e82962. https://doi.org/10.1371/journal.pone.0082962
- Wangchuk, P., Keller, P. A., Pyne, S. G., Lie, W., Willis, A. C., Rattanajak, R., & Kamchonwongpaisan, S. (2013). A new protoberberine alkaloid from Meconopsis simplicifolia (D. Don) Walpers with potent antimalarial activity against a multidrug resistant Plasmodium falciparum strain. Journal of Ethnopharmacology, 150(3), 953–959. https://doi.org/10.1016/j.jep.2013.09.052
ปี 2014
- Chitnumsub, P., Jaruwat, A., Riangrungroj, P., Ittarat, W., Noytanom, K., Oonanant, W., Vanichthanankul, J., Chuankhayan, P., Maenpuen, S., Chen, C., Chaiyen, P., Yuthavong, Y., & Leartsakulpanich, U. (2014). Structures of Plasmodium vivaxserine hydroxymethyltransferase: implications for ligand-binding specificity and functional control. Acta Crystallographica Section D Biological Crystallography, 70(12), 3177–3186. https://doi.org/10.1107/s1399004714023128
- Elsworth, B., Matthews, K., Nie, C. Q., Kalanon, M., Charnaud, S. C., Sanders, P. R., Chisholm, S. A., Counihan, N. A., Shaw, P. J., Pino, P., Chan, J., Azevedo, M. F., Rogerson, S. J., Beeson, J. G., Crabb, B. S., Gilson, P. R., & De Koning-Ward, T. F. (2014). PTEX is an essential nexus for protein export in malaria parasites. Nature, 511(7511), 587–591. https://doi.org/10.1038/nature13555
- Imprasittichail, W., Roytrakul, S., Krungkrai, S. R., & Krungkrail, J. (2014). A unique insertion of low complexity amino acid sequence underlies protein-protein interaction in human malaria parasite orotate phosphoribosyltransferase and orotidine 5’-monophosphate decarboxylase. Asian Pacific Journal of Tropical Medicine, 7(3), 184–192. https://doi.org/10.1016/s1995-7645(14)60018-3
- Kümpornsin, K., Kotanan, N., Chobson, P., Kochakarn, T., Jirawatcharadech, P., Jaru-Ampornpan, P., Yuthavong, Y., & Chookajorn, T. (2014). Biochemical and functional characterization of Plasmodium falciparum GTP cyclohydrolase I. Malaria Journal, 13(1). https://doi.org/10.1186/1475-2875-13-150
- Kümpornsin, K., Modchang, C., Heinberg, A., Ekland, E. H., Jirawatcharadech, P., Chobson, P., Suwanakitti, N., Chaotheing, S., Wilairat, P., Deitsch, K. W., Kamchonwongpaisan, S., Fidock, D. A., Kirkman, L. A., Yuthavong, Y., & Chookajorn, T. (2014). Origin of robustness in generating drug-resistant malaria parasites. Molecular Biology and Evolution, 31(7), 1649–1660. https://doi.org/10.1093/molbev/msu140
- Sereekhajornjaru, N., Somboon, C., Rattanajak, R., ; Denny, W.A., Wilairat, P., & Auparakkitanon, S. (2014). Comparison of hematin-targeting properties of pynacrine, an acridine analog of the benzonaphthyridine antimalarial pyronaridine. Acta Tropica, 140(1), 181-183. https://doi.org/10.1016/j.actatropica.2014.09.002
- Shaikh, M.S., Rana, J., Gaikwad, D., Leartsakulpanich, U., Ambre, P.K., Pissurlenkar, R.R.S., & Coutinho, E.C. (2014). Antifolate agents against wild and mutant strains of plasmodium falciparum. Indian Journal of Pharmaceutical Sciences, 76(2), 116-124. https://www.scopus.com/inward/record.uri?eid=2-s2.0-84899684756&partnerID=40&md5=0e6d111a46fc2132ecc21b195795b295
- Sleebs, B. E., Lopaticki, S., Marapana, D. S., O’Neill, M. T., Rajasekaran, P., Gazdik, M., Günther, S., Whitehead, L. W., Lowes, K. N., Barfod, L., Hviid, L., Shaw, P. J., Hodder, A. N., Smith, B. J., Cowman, A. F., & Boddey, J. A. (2014). Inhibition of plasmepsin V activity demonstrates its essential role in protein export, PFEMP1 display, and survival of malaria parasites. PLoS Biology, 12(7), e1001897. https://doi.org/10.1371/journal.pbio.1001897
- Sor-Suwan, S., Jariyapan, N., Roytrakul, S., Paemanee, A., Phumee, A., Phattanawiboon, B., Intakhan, N., Chanmol, W., Bates, P. A., Saeung, A., & Choochote, W. (2014). Identification of salivary gland proteins depleted after blood feeding in the malaria vector Anopheles campestris-like mosquitoes (Diptera: Culicidae). PLoS ONE, 9(3), e90809. https://doi.org/10.1371/journal.pone.0090809
- Suksangpleng, T., Leartsakulpanich, U., Moonsom, S., Siribal, S., Boonyuen, U., Wright, G. E., & Chavalitshewinkoon-Petmitr, P. (2014). Molecular characterization of Plasmodium falciparum uracil-DNA glycosylase and its potential as a new anti-malarial drug target. Malaria Journal, 13(1). https://doi.org/10.1186/1475-2875-13-149
- Wongsombat, C., Aroonsri, A., Kamchonwongpaisan, S., Morgan, H. P., Walkinshaw, M. D., Yuthavong, Y., & Shaw, P. J. (2014). Molecular characterization of Plasmodium falciparum Bruno/CELF RNA binding proteins. Molecular and Biochemical Parasitology, 198(1), 1–10. https://doi.org/10.1016/j.molbiopara.2014.10.005
- Yongkiettrakul, S., Jaroenram, W., Arunrut, N., Chareanchim, W., Pannengpetch, S., Suebsing, R., Kiatpathomchai, W., Pornthanakasem, W., Yuthavong, Y., & Kongkasuriyachai, D. (2014). Application of loop-mediated isothermal amplification assay combined with lateral flow dipstick for detection of Plasmodium falciparum and Plasmodium vivax. Parasitology International, 63(6), 777–784. https://doi.org/10.1016/j.parint.2014.06.004
ปี 2015
- Shaw, P. J., Chaotheing, S., Kaewprommal, P., Piriyapongsa, J., Wongsombat, C., Suwannakitti, N., Koonyosying, P., Uthaipibull, C., Yuthavong, Y., & Kamchonwongpaisan, S. (2015). Plasmodium parasites mount an arrest response to dihydroartemisinin, as revealed by whole transcriptome shotgun sequencing (RNA-seq) and microarray study. BMC Genomics, 16(1), 830. https://doi.org/10.1186/s12864-015-2040-0
- Talawanich, Y., Kamchonwongpaisan, S., Sirawaraporn, W., & Yuthavong, Y. (2015). Use of bacterial surrogates as a tool to explore antimalarial drug interaction: Synergism between inhibitors of malarial dihydrofolate reductase and dihydropteroate synthase. Acta Tropica, 149, 64–69. https://doi.org/10.1016/j.actatropica.2015.05.011
- Thipubon, P., Tipsuwan, W., Uthaipibull, C., Santitherakul, S., & Srichairatanakool, S. (2015). Anti-malarial effect of 1-(N-acetyl-6-aminohexyl)-3-hydroxy-2-methylpyridin-4-one and green tea extract on erythrocyte-stage Plasmodium berghei in mice. Asian Pacific Journal of Tropical Biomedicine, 5(11), 932–936. https://doi.org/10.1016/j.apjtb.2015.07.021
- Thipubon, P., Uthaipibull, C., Kamchonwongpaisan, S., Tipsuwan, W., & Srichairatanakool, S. (2015). Inhibitory effect of novel iron chelator, 1-(N-acetyl-6-aminohexyl)-3-hydroxy-2-methylpyridin-4-one (CM1) and green tea extract on growth of Plasmodium falciparum. Malaria Journal, 14(1). https://doi.org/10.1186/s12936-015-0910-1
- Witschel, M. C., Rottmann, M., Schwab, A., Leartsakulpanich, U., Chitnumsub, P., Seet, M., Tonazzi, S., Schwertz, G., Stelzer, F., Mietzner, T., McNamara, C., Thater, F., Freymond, C., Jaruwat, A., Pinthong, C., Riangrungroj, P., Oufir, M., Hamburger, M., Mäser, P., . . . Diederich, F. (2015). Inhibitors of plasmodial serine hydroxymethyltransferase (SHMT): cocrystal structures of pyrazolopyrans with potent blood- and liver-stage activities. Journal of Medicinal Chemistry, 58(7), 3117–3130. https://doi.org/10.1021/jm501987h
ปี 2016
- Aroonsri, A., Akinola, O., Posayapisit, N., Songsungthong, W., Uthaipibull, C., Kamchonwongpaisan, S., Gbotosho, G. O., Yuthavong, Y., & Shaw, P. J. (2016). Identifying antimalarial compounds targeting dihydrofolate reductase-thymidylate synthase (DHFR-TS) by chemogenomic profiling. International Journal for Parasitology, 46(8), 527–535. https://doi.org/10.1016/j.ijpara.2016.04.002
- Intarapanich, A., Kaewkamnerd, S., Pannarut, M., Shaw, P. J., & Tongsima, S. (2016). Fast processing of microscopic images using object-based extended depth of field. BMC Bioinformatics, 17(S19). https://doi.org/10.1186/s12859-016-1373-2
- Limudomporn, P., Moonsom, S., Leartsakulpanich, U., Suntornthiticharoen, P., Petmitr, S., Weinfeld, M., & Chavalitshewinkoon-Petmitr, P. (2016). Characterization of Plasmodium falciparum ATP-dependent DNA helicase RuvB3. Malaria Journal, 15(1). https://doi.org/10.1186/s12936-016-1573-2
- Pornthanakasem, W., Riangrungroj, P., Chitnumsub, P., Ittarat, W., Kongkasuriyachai, D., Uthaipibull, C., Yuthavong, Y., & Leartsakulpanich, U. (2016). Role of Plasmodium vivax Dihydropteroate Synthase Polymorphisms in Sulfa Drug Resistance. Antimicrobial Agents and Chemotherapy, 60(8), 4453–4463. https://doi.org/10.1128/aac.01835-15
- Posayapisit, N., Songsungthong, W., Koonyosying, P., Falade, M. O., Uthaipibull, C., Yuthavong, Y., Shaw, P. J., & Kamchonwongpaisan, S. (2016). Cytochrome c and c1 heme lyases are essential in Plasmodium berghei. Molecular and Biochemical Parasitology, 210(1–2), 32–36. https://doi.org/10.1016/j.molbiopara.2016.08.003
- Promchai, T., Jaidee, A., Cheenpracha, S., Trisuwan, K., Rattanajak, R., Kamchonwongpaisan, S., Laphookhieo, S., Pyne, S. G., & Ritthiwigrom, T. (2016). Antimalarial Oxoprotoberberine Alkaloids from the Leaves of Miliusa cuneata. Journal of Natural Products, 79(4), 978–983. https://doi.org/10.1021/acs.jnatprod.5b01054
- Shaw, P. J., Kaewprommal, P., Piriyapongsa, J., Wongsombat, C., Yuthavong, Y., & Kamchonwongpaisan, S. (2016). Estimating mRNA lengths from Plasmodium falciparum genes by Virtual Northern RNA-seq analysis. International Journal for Parasitology, 46(1), 7–12. https://doi.org/10.1016/j.ijpara.2015.09.007
- Somsak, V., Srichairatanakool, S., Uthaipibull, C. (2016). Anti-hypoglycemic effect of aqueous leaf extract of Siamese neem tree (Azadirachta indica) in Plasmodium berghei infected mice. International Food Research Journal, 23(2). 885-888. https://www.scopus.com/inward/record.uri?eid=2-s2.0-84960921373&partnerID=40&md5=67a889875e656364f58e2dfd73eef4fe
- Songsungthong, W., Koonyosying, P., Uthaipibull, C., & Kamchonwongpaisan, S. (2016). Inhibition of Glutathione Biosynthesis Sensitizes Plasmodium berghei to Antifolates. Antimicrobial Agents and Chemotherapy, 60(5), 3057–3064. https://doi.org/10.1128/aac.01836-15
- Surat, W., Mhuantong, W., Sangsrakru, D., Chareonviriyaphap, T., Arunyawat, U., Kubera, A., Sittivicharpinyo, T., Siripan, O., Pootakham, W. (2016). Gut bacterial diversity in plasmodium-infected and plasmodium-uninfected anopheles minimus. Chiang Mai Journal of Science, 43(3), 426-439. https://www.scopus.com/inward/record.uri?eid=2-s2.0-84961784319&partnerID=40&md5=284a971eea28ef2351c33d627b31ff0f
- Vasuvat, J., Montree, A., Moonsom, S., Leartsakulpanich, U., Petmitr, S., Focher, F., Wright, G. E., & Chavalitshewinkoon-Petmitr, P. (2016). Biochemical and functional characterization of Plasmodium falciparum DNA polymerase δ. Malaria Journal, 15(1). https://doi.org/10.1186/s12936-016-1166-0
ปี 2017
- Amornwatcharapong, W., Maenpuen, S., Chitnumsub, P., Leartsakulpanich, U., & Chaiyen, P. (2017). Human and Plasmodium serine hydroxymethyltransferases differ in rate-limiting steps and pH-dependent substrate inhibition behavior. Archives of Biochemistry and Biophysics, 630, 91–100. https://doi.org/10.1016/j.abb.2017.07.017
- Chanama, S., Chitnumsub, P., Leartsakulpanich, U., Chanama, M. (2017). Distinct dimer interface of Plasmodium falciparum thymidylate synthase: Implication for species-specific antimalarial drug design. Southeast Asian Journal of Tropical Medicine and Public Health, 48(4), 722-736.
- Kongkasuriyachai, D., Yongkiettrakul, S., Kiatpathomchai, W., & Arunrut, N. (2017). Loop-Mediated Isothermal Amplification and LFD Combination for Detection of Plasmodium falciparum and Plasmodium vivax. Methods in Molecular Biology, 431–443. https://doi.org/10.1007/978-1-4939-6911-1_28
- Mataradchakul, T., Uthaipibull, C., Nosten, F., Vega-Rodriguez, J., Jacobs-Lorena, M., & Lek-Uthai, U. (2017). Plasmodium vivax rhomboid-like protease 1 gene diversity in Thailand. Experimental Parasitology, 181, 1–6. https://doi.org/10.1016/j.exppara.2017.06.007
- Nakinchat, S., Chachiyo, S., Srichairatanakool, S., Uthaipibull, C., Somsak V. (2017). Anti-hemolytic, hepatoprotective, and nephroprotective effects of black tea extract against Plasmodium berghei infected mice. Walailak Journal of Science and Technology, 14(9Special Issue), 723-729
- Schwertz, G., Frei, M. S., Witschel, M. C., Rottmann, M., Leartsakulpanich, U., Chitnumsub, P., Jaruwat, A., Ittarat, W., Schäfer, A., Aponte, R. A., Trapp, N., Mark, K., Chaiyen, P., & Diederich, F. (2017). Conformational aspects in the design of inhibitors for serine hydroxymethyltransferase (SHMT): biphenyl, aryl sulfonamide, and aryl sulfone motifs. Chemistry – a European Journal, 23(57), 14345–14357. https://doi.org/10.1002/chem.201703244
- Schwertz, G., Witschel, M. C., Rottmann, M., Bonnert, R., Leartsakulpanich, U., Chitnumsub, P., Jaruwat, A., Ittarat, W., Schäfer, A., Aponte, R. A., Charman, S. A., White, K. L., Kundu, A., Sadhukhan, S., Lloyd, M., Freiberg, G. M., Srikumaran, M., Siggel, M., Zwyssig, A., . . . Diederich, F. (2017). Antimalarial Inhibitors Targeting Serine Hydroxymethyltransferase (SHMT) with in Vivo Efficacy and Analysis of their Binding Mode Based on X-ray Cocrystal Structures. Journal of Medicinal Chemistry, 60(12), 4840–4860. https://doi.org/10.1021/acs.jmedchem.7b00008
- Shaw, P. J., & Aroonsri, A. (2017). Tools for attenuation of gene expression in malaria parasites. International Journal for Parasitology, 47(7), 385–398. https://doi.org/10.1016/j.ijpara.2016.11.006
- Songsungthong, W., Kulawonganunchai, S., Wilantho, A., Tongsima, S., Koonyosying, P., Uthaipibull, C., Kamchonwongpaisan, S., & Shaw, P. J. (2017). The Plasmodium bergheiRC strain is highly diverged and harbors putatively novel drug resistance variants. PeerJ, 5, e3766. https://doi.org/10.7717/peerj.3766
- Tangchaikeeree, T., Sawaisorn, P., Somsri, S., Polpanich, D., Putaporntip, C., Tangboriboonrat, P., Udomsangpetch, R., & Jangpatarapongsa, K. (2017). Enhanced Sensitivity for Detection of Plasmodium falciparum gametocytes by magnetic nanoparticles combined with enzyme substrate system. Talanta, 164, 645–650. https://doi.org/10.1016/j.talanta.2016.10.106
- Yongkiettrakul, S., Kampeera, J., Chareanchim, W., Rattanajak, R., Pornthanakasem, W., Kiatpathomchai, W., & Kongkasuriyachai, D. (2017). Simple detection of single nucleotide polymorphism in Plasmodium falciparum by SNP-LAMP assay combined with lateral flow dipstick. Parasitology International, 66(1), 964–971. https://doi.org/10.1016/j.parint.2016.10.024
ปี 2018
- Coghi, P., Yaremenko, I. A., Prommana, P., Radulov, P. S., Syroeshkin, M. A., Wu, Y. J., Gao, J. Y., Gordillo, F. M., Mok, S., Wong, V. K. W., Uthaipibull, C., & Terent’ev, A. O. (2018). Novel Peroxides as Promising Anticancer Agents with Unexpected Depressed Antimalarial Activity. ChemMedChem, 13(9), 902–908. https://doi.org/10.1002/cmdc.201700804
- Ittarat, W., Pornthanakasem, W., Mungthin, M., Suwandittakul, N., Leelayoova, S., Tarnchompoo, B., Yuthavong, Y., Kongkasuriyachai, D., & Leartsakulpanich, U. (2018). Characterization of Plasmodium knowlesi dihydrofolate reductase-thymidylate synthase and sensitivity to antifolates. Parasitology International, 67(6), 787–792. https://doi.org/10.1016/j.parint.2018.08.004
- Mataradchakul, T., Uthaipibull, C., Vega-Rodriguez, J., Jacobs-Lorena, M., & Lek-Uthai, U. (2018). Investigation of plasmodium vivax rhomboid-like protease 1 compared to plasmodium falciparum rhomboid protease 1 in erythrocytic cycle. Chiang Mai Journal of Science, 45(6), 2256-2266
- Sattabongkot, J., Suansomjit, C., Nguitragool, W., Sirichaisinthop, J., Warit, S., Tiensuwan, M., & Buates, S. (2018). Prevalence of asymptomatic Plasmodium infections with sub-microscopic parasite densities in the northwestern border of Thailand: a potential threat to malaria elimination. Malaria Journal, 17(1). https://doi.org/10.1186/s12936-018-2476-1
- Schwertz, G., Witschel, M. C., Rottmann, M., Leartsakulpanich, U., Chitnumsub, P., Jaruwat, A., Amornwatcharapong, W., Ittarat, W., Schäfer, A., Aponte, R. A., Trapp, N., Chaiyen, P., & Diederich, F. (2018). Potent inhibitors of plasmodial serine hydroxymethyltransferase (SHMT) featuring a spirocyclic scaffold. ChemMedChem, 13(9), 931–943. https://doi.org/10.1002/cmdc.201800053
- Tantiamornkul, K., Pumpaibool, T., Piriyapongsa, J., Culleton, R., & Lek-Uthai, U. (2018). The prevalence of molecular markers of drug resistance in Plasmodium vivax from the border regions of Thailand in 2008 and 2014. International Journal for Parasitology Drugs and Drug Resistance, 8(2), 229–237. https://doi.org/10.1016/j.ijpddr.2018.04.003
- Tarnchompoo, B., Chitnumsub, P., Jaruwat, A., Shaw, P. J., Vanichtanankul, J., Poen, S., Rattanajak, R., Wongsombat, C., Tonsomboon, A., Decharuangsilp, S., Anukunwithaya, T., Arwon, U., Kamchonwongpaisan, S., & Yuthavong, Y. (2018). Hybrid Inhibitors of Malarial Dihydrofolate Reductase with Dual Binding Modes That Can Forestall Resistance. ACS Medicinal Chemistry Letters, 9(12), 1235–1240. https://doi.org/10.1021/acsmedchemlett.8b00389
ปี 2019
- Aroonsri, A., Posayapisit, N., Kongsee, J., Siripan, O., Vitsupakorn, D., Utaida, S., Uthaipibull, C., Kamchonwongpaisan, S., & Shaw, P. J. (2019). Validation of Plasmodium falciparumdeoxyhypusine synthase as an antimalarial target. PeerJ, 7, e6713. https://doi.org/10.7717/peerj.6713
- Saepua, S., Sadorn, K., Vanichtanankul, J., Anukunwithaya, T., Rattanajak, R., Vitsupakorn, D., Kamchonwongpaisan, S., Yuthavong, Y., & Thongpanchang, C. (2019). 6-Hydrophobic aromatic substituent pyrimethamine analogues as potential antimalarials for pyrimethamine-resistant Plasmodium falciparum. Bioorganic & Medicinal Chemistry, 27(24), 115158. https://doi.org/10.1016/j.bmc.2019.115158
ปี 2020
- Chaianantakul, N., Sungkapong, T., Supatip, J., Kingsang, P., Kamlaithong, S., & Suwanakitti, N. (2020). Antimalarial effect of cell penetrating peptides derived from the junctional region of Plasmodium falciparum dihydrofolate reductase-thymidylate synthase. Peptides, 131, 170372. https://doi.org/10.1016/j.peptides.2020.170372
- Chansaenpak, K., Jangpatarapongsa, K., & Polpanich, D. (2020). Bioprobe-conjugate polymeric micro/nanoparticles as detection tools for infectious diseases. In Elsevier eBooks (pp. 567–595). https://doi.org/10.1016/b978-0-12-821506-7.00022-3
- Chitnumsub, P., Jaruwat, A., Talawanich, Y., Noytanom, K., Liwnaree, B., Poen, S., & Yuthavong, Y. (2020). The structure of Plasmodium falciparum hydroxymethyldihydropterin pyrophosphokinase‐dihydropteroate synthase reveals the basis of sulfa resistance. FEBS Journal, 287(15), 3273–3297. https://doi.org/10.1111/febs.15196
- Green, J. L., Wu, Y., Encheva, V., Lasonder, E., Prommaban, A., Kunzelmann, S., Christodoulou, E., Grainger, M., Truongvan, N., Bothe, S., Sharma, V., Song, W., Pinzuti, I., Uthaipibull, C., Srichairatanakool, S., Birault, V., Langsley, G., Schindelin, H., Stieglitz, B., . . . Holder, A. A. (2020). Ubiquitin activation is essential for schizont maturation in Plasmodium falciparum blood-stage development. PLoS Pathogens, 16(6), e1008640. https://doi.org/10.1371/journal.ppat.1008640
- Isaka, M., Chinthanom, P., Rachtawee, P., Choowong, W., Choeyklin, R., & Thummarukcharoen, T. (2020). Lanostane triterpenoids from cultivated fruiting bodies of the wood-rot basidiomycete Ganoderma casuarinicola. Phytochemistry, 170, 112225. https://doi.org/10.1016/j.phytochem.2019.112225
- Jupatanakul, N., Pengon, J., Selisana, S. M. G., Choksawangkarn, W., Jaito, N., Saeung, A., Bunyong, R., Posayapisit, N., Thammatinna, K., Kalpongnukul, N., Aupalee, K., Pisitkun, T., & Kamchonwongpaisan, S. (2020). Serratia marcescens secretes proteases and chitinases with larvicidal activity against Anopheles dirus. Acta Tropica, 212, 105686. https://doi.org/10.1016/j.actatropica.2020.105686
- Kamchonwongpaisan, S., Charoensetakul, N., Srisuwannaket, C., Taweechai, S., Rattanajak, R., Vanichtanankul, J., Vitsupakorn, D., Arwon, U., Thongpanchang, C., Tarnchompoo, B., Vilaivan, T., & Yuthavong, Y. (2020). Flexible diaminodihydrotriazine inhibitors of Plasmodium falciparum dihydrofolate reductase: Binding strengths, modes of binding and their antimalarial activities. European Journal of Medicinal Chemistry, 195, 112263. https://doi.org/10.1016/j.ejmech.2020.112263
- Kornsakulkarn, J., Palasarn, S., Choowong, W., Thongpanchang, T., Boonyuen, N., Choeyklin, R., Boonpratuang, T., Isaka, M., & Thongpanchang, C. (2020). Antimalarial 9-Methoxystrobilurins, Oudemansins, and Related Polyketides from Cultures of Basidiomycete Favolaschia Species. Journal of Natural Products, 83(4), 905–917. https://doi.org/10.1021/acs.jnatprod.9b00647
- Kudisthalert, W., Pasupa, K., & Tongsima, S. (2020). Counting and classification of malarial parasite from Giemsa-Stained thin film images. IEEE Access, 8, 78663–78682. https://doi.org/10.1109/access.2020.2990497
- Posuwan, N., Wanlapakorn, N., Sintusek, P., Wasitthankasem, R., Poovorawan, K., Vongpunsawad, S., & Poovorawan, Y. (2020). Towards the elimination of viral hepatitis in Thailand by the year 2030. Journal of Virus Eradication, 6(3), 100003. https://doi.org/10.1016/j.jve.2020.100003
- Yaremenko, I. A., Coghi, P., Prommana, P., Qiu, C., Radulov, P. S., Qu, Y., Belyakova, Y. Y., Zanforlin, E., Kokorekin, V. A., Wu, Y. Y. J., Fleury, F., Uthaipibull, C., Wong, V. K. W., & Terent’ev, A. O. (2020). Synthetic peroxides promote apoptosis of cancer cells by inhibiting P‐Glycoprotein ABCB5. ChemMedChem, 15(13), 1118–1127. https://doi.org/10.1002/cmdc.202000042
- Yongkiettrakul, S., Kolié, F. R., Kongkasuriyachai, D., Sattabongkot, J., Nguitragool, W., Nawattanapaibool, N., Suansomjit, C., Warit, S., Kangwanrangsan, N., & Buates, S. (2020). Validation of PfSNP-LAMP-lateral flow dipstick for detection of single nucleotide polymorphism associated with pyrimethamine resistance in plasmodium falciparum. Diagnostics, 10(11), 948. https://doi.org/10.3390/diagnostics10110948
ปี 2021
- Dawurung, C. J., Nguyen, M. T. H., Pengon, J., Dokladda, K., Bunyong, R., Rattanajak, R., Kamchonwongpaisan, S., Nguyen, P. T. M., & Pyne, S. G. (2021). Isolation of bioactive compounds from medicinal plants used in traditional medicine: Rautandiol B, a potential lead compound against Plasmodium falciparum. BMC Complementary Medicine and Therapies, 21(1). https://doi.org/10.1186/s12906-021-03406-y
- Hoarau, M., Vanichtanankul, J., Srimongkolpithak, N., Vitsupakorn, D., Yuthavong, Y., & Kamchonwongpaisan, S. (2021). Discovery of new non-pyrimidine scaffolds as Plasmodium falciparum DHFR inhibitors by fragment-based screening. Journal of Enzyme Inhibition and Medicinal Chemistry, 36(1), 198–206. https://doi.org/10.1080/14756366.2020.1854244
- Intaraudom, C., Bunbamrung, N., Dramae, A., Boonyuen, N., Choowong, W., Rachtawee, P., & Pittayakhajonwut, P. (2019). Chromone derivatives, R- and S- taeniolin, from the marine-derived fungus Taeniolella sp. BCC31839. Natural Product Research, 35(3), 392–398. https://doi.org/10.1080/14786419.2019.1634710
- Jansongsaeng, S., Srimongkolpithak, N., Pengon, J., Kamchonwongpaisan, S., & Khotavivattana, T. (2021). 5-Phenoxy primaquine analogs and the tetraoxane hybrid as antimalarial agents. Molecules, 26(13), 3991. https://doi.org/10.3390/molecules26133991
- Maneekesorn, S., Chuljerm, H., Koonyosying, P., Uthaipibull, C., Ma, Y., & Srichairatanakool, S. (2021). Identifying a Deferiprone–Resveratrol hybrid as an effective lipophilic Anti-Plasmodial agent. Molecules, 26(13), 4074. https://doi.org/10.3390/molecules26134074
- Posayapisit, N., Pengon, J., Prommana, P., Shoram, M., Yuthavong, Y., Uthaipibull, C., Kamchonwongpaisan, S., & Jupatanakul, N. (2021). Transgenic pyrimethamine-resistant plasmodium falciparum reveals transmission-blocking potency of P218, a novel antifolate candidate drug. International Journal for Parasitology, 51(8), 635–642. https://doi.org/10.1016/j.ijpara.2020.12.002
- Shaw, P. J., Piriyapongsa, J., Kaewprommal, P., Wongsombat, C., Chaosrikul, C., Teeravajanadet, K., Boonbangyang, M., Uthaipibull, C., Kamchonwongpaisan, S., & Tongsima, S. (2021). Identifying transcript 5′ capped ends in Plasmodium falciparum. PeerJ, 9, e11983. https://doi.org/10.7717/peerj.11983
- Suwannin, P., Polpanich, D., Leelayoova S., Mungthin, M., Tangboriboonrat, P., Elaissari, A., Jangpatarapongsa, K.; Ruang-areerate, T., & Tangchaikeeree, T. (2021). Heat-enhancing aggregation of gold nanoparticles combined with loop-mediated isothermal amplification (HAG-LAMP) for Plasmodium falciparum detection. Journal of Pharmaceutical and Biomedical Analysis, 203(114178). https://doi.org/10.1016/j.jpba.2021.114178
ปี 2022
- Ajingi, Y. S., Rukying, N., Aroonsri, A., & Jongruja, N. (2022). Recombinant active peptides and their therapeutic functions. Current Pharmaceutical Biotechnology, 23(5), 645–663. https://doi.org/10.2174/1389201022666210702123934
- Coghi, P., Yaremenko, I. A., Prommana, P., Wu, J. N., Zhang, R. L., Ng, J. P. L., Belyakova, Y. Y., Law, B. Y. K., Radulov, P. S., Uthaipibull, C., Wong, V. K. W., & Terent’ev, A. O. (2022). Antimalarial and anticancer activity evaluation of bridged ozonides, aminoperoxides, and tetraoxanes. ChemMedChem, 17(20). https://doi.org/10.1002/cmdc.202200328
- Guth, J., Lamy, M., Murali, N., Pankaj, P., & Yuthavong, Y. (2022). Meeting malaria elimination targets and remaining challenges: Qualitative research on perceptions of stakeholders in India and Southeast Asia. Asia & the Pacific Policy Studies, 9(2), 178–195. https://doi.org/10.1002/app5.347
- Hoarau, M., Suwanakitti, N., Varatthan, T., Thiabma, R., Rattanajak, R., Charoensetakul, N., Redman, E. K., Khotavivattana, T., Vilaivan, T., Yuthavong, Y., & Kamchonwongpaisan, S. (2022). Assay development and identification of the first Plasmodium falciparum 7,8-dihydro-6-hydroxymethylpterin-pyrophosphokinase inhibitors. Molecules, 27(11), 3515. https://doi.org/10.3390/molecules27113515
- Iwanaga, S., Kubota, R., Nishi, T., Kamchonwongpaisan, S., Srichairatanakool, S., Shinzawa, N., Syafruddin, D., Yuda, M., & Uthaipibull, C. (2022). Genome-wide functional screening of drug-resistance genes in Plasmodium falciparum. Nature Communications, 13(1). https://doi.org/10.1038/s41467-022-33804-w
- Kampoun, T., Srichairatanakool, S., Prommana, P., Shaw, P. J., Green, J. L., Knuepfer, E., Holder, A. A., & Uthaipibull, C. (2022). Apicoplast ribosomal protein S10-V127M enhances artemisinin resistance of a Kelch13 transgenic Plasmodium falciparum. Malaria Journal, 21(1). https://doi.org/10.1186/s12936-022-04330-3
- Kuaprasert, B., Chitnumsub, P., Leartsakulpanich, U., Riangrungroj, P., Suginta, W., Leelayoova, S., Mungthin, M., Sitthichot, N., Rattanabunyong, S., Kiriwan, D., & Choowongkomon, K. (2022). Dual role of azo compounds in inhibiting Plasmodium falciparum adenosine deaminase and hemozoin biocrystallization. Experimental Parasitology, 243, 108384. https://doi.org/10.1016/j.exppara.2022.108384
- Kunasol, C., Dondorp, A. M., Batty, E. M., Nakhonsri, V., Sinjanakhom, P., Day, N. P. J., & Imwong, M. (2022). Comparative analysis of targeted next-generation sequencing for Plasmodium falciparum drug resistance markers. Scientific Reports, 12(1). https://doi.org/10.1038/s41598-022-09474-5
- Pethrak, C., Posayapisit, N., Pengon, J., Suwanakitti, N., Saeung, A., Shorum, M., Aupalee, K., Taai, K., Yuthavong, Y., Kamchonwongpaisan, S., & Jupatanakul, N. (2021). New insights into antimalarial chemopreventive activity of antifolates. Antimicrobial Agents and Chemotherapy, 66(2). https://doi.org/10.1128/aac.01538-21
- Shaw, P. J., Kaewprommal, P., Wongsombat, C., Ngampiw, C., Taechalertpaisarn, T., Kamchonwongpaisan, S., Tongsima, S., & Piriyapongsa, J. (2022). Transcriptomic complexity of the human malaria parasite Plasmodium falciparum revealed by long-read sequencing. PLoS ONE, 17(11), e0276956. https://doi.org/10.1371/journal.pone.0276956
- Sudsumrit, S., Chamchoy, K., Songdej, D., Adisakwattana, P., Krudsood, S., Adams, E. R., Imwong, M., Leartsakulpanich, U., & Boonyuen, U. (2022). Genotype-phenotype association and biochemical analyses of glucose-6-phosphate dehydrogenase variants: Implications for the hemolytic risk of using 8-aminoquinolines for radical cure. Frontiers in Pharmacology, 13. https://doi.org/10.3389/fphar.2022.1032938
- Vimonpatranon, S., Roytrakul, S., Phaonakrop, N., Lekmanee, K., Atipimonpat, A., Srimark, N., Sukapirom, K., Chotivanich, K., Khowawisetsut, L., & Pattanapanyasat, K. (2022). Extracellular vesicles derived from early and late stage Plasmodium falciparum-infected red blood cells contain invasion-associated proteins. Journal of Clinical Medicine, 11(14), 4250. https://doi.org/10.3390/jcm11144250
- Wansri, R., Lin, A. C. K., Pengon, J., Kamchonwongpaisan, S., Srimongkolpithak, N., Rattanajak, R., Wilasluck, P., Deetanya, P., Wangkanont, K., Hengphasatporn, K., Shigeta, Y., Liangsakul, J., Suroengrit, A., Boonyasuppayakorn, S., Chuanasa, T., De-Eknamkul, W., Hannongbua, S., Rungrotmongkol, T., & Chamni, S. (2022). Semi-Synthesis of N-Aryl Amide Analogs of Piperine from Piper nigrum and Evaluation of Their Antitrypanosomal, Antimalarial, and Anti-SARS-CoV-2 Main Protease Activities. Molecules, 27(9), 2841. https://doi.org/10.3390/molecules27092841
- Wongsombat, C., Yingchutrakul, Y., Suwanakitti, N., Leetanasaksakul, K., Roytrakul, S., Shaw, P. J., & Aroonsri, A. (2021). Identification of mRNA 5′ cap-associated proteins in the human malaria parasite Plasmodium falciparum. Molecular and Biochemical Parasitology, 247, 111443. https://doi.org/10.1016/j.molbiopara.2021.111443
ปี 2023
- Bandatang, R., Panklang, N., Horprathum, M., Trirongjitmoah, S., & Techaumnat, B. (2023). Electrical characterization of normal and malaria infected red blood cells by electrorotation. 2023 IEEE International Conference on Sensors and Nanotechnology, SENNANO 2023, 25-28. https://doi.org/10.1109/SENNANO57767.2023.10352558
- Kampoun, T., Koonyosying, P., Ruangsuriya, J., Prommana, P., Shaw, P.J., Kamchonwongpaisan, S., Suwito, H., Puspaningsih, N.N.T., Uthaipibull, C., & Srichairatanakool, S. (2023). Antagonistic antimalarial properties of a methoxyamino chalcone derivative and 3-hydroxypyridinones in combination with dihydroartemisinin against Plasmodium falciparum. PeerJ, https://doi.org/11. 10.7717/peerj.15187.
- Panklang, N., Vijitnukoonpradit, K., Putaporntip, C., Chotivanich, K., Nakano, M., Horprathum, M., & Techaumnat, B. (2023). Study on the dielectrophoretic characteristics of malaria-infected red blood cells. Electrophoresis, 44(23), 1837-1846. https://doi.org/10.1002/elps.202300088
- Posayapisit, N., Pengon, J., Shaw, P.J., Uthaipibull, C., Kongkasuriyachai, D., Phyo, A.P., Nosten, F., Yuthavong, Y., & Kamchonwongpaisan, S. (2023). Susceptibility of Southeast Asian Plasmodium falciparum isolates to P218. International Journal of Antimicrobial Agents, 62(1), 106838. https://doi.org/10.1016/j.ijantimicag.2023.106838
- Ruengket, P., Roytrakul, S., Tongthainan, D., Taruyanon, K., Sangkharak, B., Limudomporn, P., Pongsuchart, M., Udom, C., & Fungfuang, W. (2023). Serum proteomic profile of wild stump-tailed macaques (Macaca arctoides) infected with malaria parasites in Thailand. PLoS ONE, 18(11), e0293579. https://doi.org/10.1371/journal.pone.0293579
- Wiriyasirivaj, S., Mahakunkijcharoen, Y., Uthaipibul, C., & Hirunpetcharat, C. (2023). Molecular and immunological characterizations of potentially protective blood-stage plasmodium yoelii antigens. Southeast Asian Journal of Tropical Medicine and Public Health, 54(6), 332-352.
ปี 2024
- Ashar, M. S. a. A., Prommana, P., Taechalertpaisarn, T., & Uthaipibull, C. (2024). Identification of Plasmodium infection in cynomolgus macaque and rhesus macaque monkeys in Thailand forests. AIP Conference Proceedings, 3165, 020001. https://doi.org/10.1063/5.0218055
- Decharuangsilp, S., Arwon, U., Sooksai, N., Rattanajak, R., Saeyang, T., Vitsupakorn, D., Vanichtanankul, J., Yuthavong, Y., Kamchonwongpaisan, S., & Hoarau, M. (2024). Novel flexible biphenyl PFDHFR inhibitors with improved antimalarial activity. RSC Medicinal Chemistry, 15(7), 2496–2507. https://doi.org/10.1039/d4md00197d
- Leela, N., Prommana, P., Kamchonwongpaisan, S., Taechalertpaisarn, T., & Shaw, P. J. (2024). Antimalarial target vulnerability of the putative Plasmodium falciparum methionine synthase. PeerJ, 12, e16595. https://doi.org/10.7717/peerj.16595
- Panklang, N., Techaumnat, B., Tanthanuch, N., Chotivanich, K., Horprathum, M., & Nakano, M. (2024). On-chip impedance spectroscopy of malaria-infected red blood cells. Sensors, 24(10), 3186. https://doi.org/10.3390/s24103186
- Saeung, M., Pengon, J., Pethrak, C., Thaiudomsup, S., Lhaosudto, S., Saeung, A., Manguin, S., Chareonviriyaphap, T., & Jupatanakul, N. (2024). Dirus complex species identification PCR (DiCSIP) improves the identification of Anopheles dirus complex from the Greater Mekong Subregion. Parasites & Vectors, 17(1). https://doi.org/10.1186/s13071-024-06321-6
- Suwanakitti, N., Talawanich, Y., Vanichtanankul, J., Taweechai, S., Yuthavong, Y., Kamchonwongpaisan, S., & Kongkasuriyachai, D. (2024). folA thyA knockout E. coli as a suitable surrogate model for evaluation of antifolate sensitivity against PfDHFR-TS. Acta Tropica, 258, 107360. https://doi.org/10.1016/j.actatropica.2024.107360
- Trirattanaporn, N., Rattanajak, R., Dokladda, K., Kamchonwongpaisan, S., & Thongyoo, P. (2024). Design, synthesis and Anti-Plasmodial activity of Mortiamide-Lugdunin conjugates. Bioorganic Chemistry, 146, 107307. https://doi.org/10.1016/j.bioorg.2024.107307
ปี 2025
- Coghi, P., Yaremenko, I. A., Prommana, P., Nasim, A. A., Belyakova, Y. Y., Chen, R., Radulov, P. S., Uthaipibull, C., Terent’ev, A. O., & Wong, V. K. W. (2025). N‐substituted bridged azaozonides as promising antimalarial agents. ChemMedChem. https://doi.org/10.1002/cmdc.202500181
- Saeung, M., Jupatanakul, N., Afelt, A., Suksirisawat, K., Lhaosudto, S., Ahebwa, A., Hii, J., Manguin, S., & Chareonviriyaphap, T. (2025). Insights into spatio-temporal dynamics of Anopheles vectors while approaching malaria elimination along the Thailand-Cambodia border. Acta Tropica, 107545. https://doi.org/10.1016/j.actatropica.2025.107545
- Saeung, M., Jupatanakul, N., Hii, J., Thanispong, K., Chareonviriyaphap, T., & Manguin, S. (2025). Overview of national and local efforts to eliminate malaria in Thailand. Trends in Parasitology, 41(1), 52–65. https://doi.org/10.1016/j.pt.2024.11.006
- Siriyod, N., Prabowo, M. H., Cheeveewattanagul, N., Manopwisedjaroen, K., Nguitragool, W., Sattabongkot, J., Surareungchai, W., & Rijiravanich, P. (2025). Microfluidic paper-based analytical device for point-of-care nucleic acid quantification of malaria. Microchemical Journal, 113139. https://doi.org/10.1016/j.microc.2025.113139
รางวัลที่ได้รับจากผลงานการวิจัยและพัฒนาเกี่ยวกับการพัฒนายารักษาโรคมาลาเรีย
- พ.ศ. 2559 รางวัล DMSc Award โดย กรมวิทยาศาสตร์การแพทย์ กระทรวงสาธารณสุข ร่วมกับ มูลนิธิกรมวิทยาศาสตร์การแพทย์ เพื่อเชิดชูผู้ที่สร้างสรรค์ผลงานดีเยี่ยมทางวิทยาศาสตร์การแพทย์ที่ส่งเสริมงานด้านสาธารณสุข โดยได้รับรางวัล รางวัลรองชนะเลิศ ประเภทงานวิจัยและพัฒนาทางวิทยาศาสตร์การแพทย์ จากผลงาน “Plasmodium serine hydroxymethyltransferase for anti-malarial drug development” ซึ่งผลงานดังกล่าวเป็นการค้นพบโปรตีนเป้าหมายตัวใหม่ ซีรีน ไฮดรอกซีเมทิลทรานสเฟอเรส (serine hydroxymethyltransferase) หรือ SHMT โดยการยับยั้งการทำงานของเอนไซม์ SHMT นี้ส่งผลให้เชื้อมาลาเรียตาย ซึ่งเอนไซม์ SHMT ของเชื้อมาลาเรียมีลักษณะจำเพาะที่แตกต่างจากเอนไซม์ SHMT ของสิ่งมีชีวิตอื่นรวมถึงคนด้วย จึงมีศักยภาพในการนำมาพัฒนาออกแบบสารยับยั้ง เพื่อใช้ในการรับมือกับการดื้อยาของเชื้อมาลาเรียในอนาคต
- พ.ศ. 2561 งาน “วันนักประดิษฐ์” โดย สำนักงานคณะกรรมการวิจัยแห่งชาติ (วช.) ได้รับรางวัลระดับดีมาก สาขาวิทยาศาสตร์การแพทย์ จากผลงานวิจัยเรื่อง “ระบบการควบคุมการแสดงออกของยีนในเชื้อมาลาเรียโดยไรโบไซม์ กลิมเอสและการประยุกต์ใช้เพื่อการพัฒนายา” งานวิจัยดังกล่าวเป็นการนำไรโบไซม์กลิมเอสมาใช้เป็นเครื่องมือทางรีเวิร์สเจเนติกส์เพื่อควบคุมการแสดงออกของยีนไดไฮโดรโฟเลตรีดักเทสไธมิดิเลทซินเธสในเชื้อพลาสโมเดียมฟาลซิปารัมซึ่งเป็นเชื้อก่อโรคมาลาเรียในมนุษย์ โดยพบว่าเมื่อเชื้อมาลาเรียปรับแต่งพันธุกรรมถูกเลี้ยงในสภาวะที่มีน้ำตาลกลูโคซามีน ยีนไดไฮโดรโฟเลตรีดักเทสไธมิดิเลทซินเธสจะลดการแสดงออกและมีการเจริญเติบโตลดลง และมีความไวต่อยาที่มุ่งเป้าต่อเอนไซม์ไดไฮโดรโฟเลตรีดักเทสไธมิดิเลทซินเธสสูงขึ้นอย่างมีนัยสำคัญ เมื่อนำเชื้อปรับแต่งพันธุกรรมข้างต้นไปทดสอบกับสารที่มีฤทธิ์ต้านมาลาเรียในคลังสารต้านมาลาเรียซึ่งได้รับจากองค์กร Medicines for Malaria Venture (MMV) พบว่าสามารถพิสูจน์เป้าหมายของสารออกฤทธิ์ต้านมาลาเรียได้ทั้งหมด 2 ชนิด องค์ความรู้ที่ได้จากงานวิจัยนี้นำไปสู่การใช้ไรโบไซม์กลิมเอสในการค้นพบหน้าที่ของยีนที่สำคัญใหม่ๆ ของเชื้อมาลาเรีย ซึ่งจะมีประโยชน์อย่างมากในการค้นหาและพัฒนายาต้านมาลาเรียชนิดใหม่ ซึ่งเป็นที่ต้องการอย่างเร่งด่วนเพื่อต่อสู้กับเชื้อมาลาเรียดื้อยาในปัจจุบัน

แหล่งข้อมูล
-
- NGThai. (2562, กันยายน 23). ครั้งแรกของ นักวิจัยไทย ที่ยกระดับงานวิจัยของชาติโดยการส่งชุดการทดลองเชื้อไข้มาลาเรียไปทดลองบนสถานีอวกาศนานาชาติ. National Geographic ฉบับภาษาไทย. https://ngthai.com/news-activity/24936/malaria-in-space/
- กรุงเทพธุรกิจ. (2557, พฤษภาคม 3). สวทช. เปิดตัวยาต้านมาลาเรีย. กรุงเทพธุรกิจ. https://www.bangkokbiznews.com/tech/579375
- ข่าวสด. (2565, มกราคม 24). นักวิจัย ไบโอเทค สวทช. ร่วมกับ FIMECS, Inc. ประเทศญี่ปุ่น ใช้เทคโนโลยี PROTAC. ข่าวสดออนไลน์. https://www.khaosod.co.th/pr-news/news_6849327
- ไทยพีบีเอส. (2566, ธันวาคม 13). เปิดตัว “P218” ยาต้านมาลาเรียตัวแรกของไทย. ไทยพีบีเอส. https://www.thaipbs.or.th/news/content/334871
- นาตยา คชินทร. (2557, เมษายน 24). ‘P218’ สารต้านมาลาเรียชนิดใหม่ยาตัวแรกที่ผลิตโดยฝีมือคนไทย – ฉลาดคิด. เดลินิวส์. https://www.dailynews.co.th/it/232320/
- มติชน. (2562, สิงหาคม 10). โปรตีนพัฒนายาต้านมาลาเรียออกนอกโลกแล้ว นักวิจัยชี้ ตกผลึกในอวกาศฆ่าเชื้อดื้อยา. มติชนออนไลน์. https://www.matichon.co.th/local/news_1619413
- ศูนย์พันธุวิศวกรรมและเทคโนโลยีแห่งชาติ. (2564). รายงานประจำปี 2564 ศูนย์พันธุวิศวกรรมและเทคโนโลยีแห่งชาติ. ปทุมธานี : ศูนย์ฯ.
- ศูนย์พันธุวิศวกรรมและเทคโนโลยีแห่งชาติ. (2563). รายงานประจำปี 2563 ศูนย์พันธุวิศวกรรมและเทคโนโลยีแห่งชาติ. ปทุมธานี : ศูนย์ฯ.
- ศูนย์พันธุวิศวกรรมและเทคโนโลยีแห่งชาติ. (2560). รายงานประจำปี 2560 ศูนย์พันธุวิศวกรรมและเทคโนโลยีแห่งชาติ. ปทุมธานี : ศูนย์ฯ.
- ศูนย์พันธุวิศวกรรมและเทคโนโลยีแห่งชาติ. (2556). รายงานประจำปี 2556 ศูนย์พันธุวิศวกรรมและเทคโนโลยีแห่งชาติ. ปทุมธานี : ศูนย์ฯ.
- ศูนย์พันธุวิศวกรรมและเทคโนโลยีชีวภาพแห่งชาติ. (2566, ธันวาคม 13). อว. โดย “สวทช.” และ “มหิดล” จับมือพัฒนายาต้านมาลาเรียตัวแรกของประเทศที่กำลังพัฒนา. https://www.biotec.or.th/home/mou-p218-th/
- สำนักงานพัฒนาเทคโนโลยีอวกาศและภูมิสารสนเทศ (องค์การมหาชน). (2563, มิถุนายน 16). จิสด้า ไบโอเทค สวทช. และ JAXA ผนึกกำลังปลูกผลึกโปรตีนบนสถานีอวกาศสำเร็จแล้ว!. GISTDA Activities. https://gistda.or.th/news_view.php?n_id=3548&lang=EN
- สำนักงานพัฒนาวิทยาศาสตร์และเทคโนโลยีแห่งชาติ. (2564). 3 ทศวรรษ สวทช. กับการขับเคลื่อนประเทศด้วยวิทยาศาสตร์และเทคโนโลยี : สุขภาพและการแพทย์. ปทุมธานี : สำนักงานฯ.
- สำนักงานพัฒนาวิทยาศาสตร์และเทคโนโลยีแห่งชาติ. (2564, กุมภาพันธ์ 25). 30th Anniversary Story of NSTDA: 30 ปี สวทช. วิจัยยาต้านมาลาเรียเพื่อมนุษยชาติ. https://www.nstda.or.th/home/news_post/30th-anniversary-story-of-nstda-malaria/
- สำนักงานพัฒนาวิทยาศาสตร์และเทคโนโลยีแห่งชาติ. (2564, มิถุนายน 9). “P218” สารต้านมาลาเรียชนิดใหม่ฝีมือคนไทย. https://www.nstda.or.th/home/performance_post/p218-antimalarial-agents/
- สำนักงานพัฒนาวิทยาศาสตร์และเทคโนโลยีแห่งชาติ. (2563). กว่าจะมาเป็นนักวิทยาศาสตร์ที่ชื่อ “ยงยุทธ ยุทธวงศ์”. นิตยสารสาระวิทย์. https://www.nstda.or.th/sci2pub/yongyuth-yutthavong/
- สำนักงานพัฒนาวิทยาศาสตร์และเทคโนโลยีแห่งชาติ. (2559). การสัมมนาเรื่อง จาก “การค้นพบยาต้านมาลาเรีย P218” สู่ “โอกาสและความท้าทายในด้านการพัฒนายาในประเทศไทย” From “Discovery of Antimalarial P218” to “Opportunities and Challenges for Drug Development in Thailand” วันพฤหัสบดีที่ 31 มีนาคม 2559 ห้องประชุม CC-305 ชั้น 3 อาคารศูนย์ประชุมอุทยานวิทยาศาสตร์ประเทศไทย. 12th NSTDA Annual Conference (NAC2016).
